微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室可利用反应“Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O”制取SO2,下列措施能降低该化学反应速率的是( )
A.适当降低反应温度
B.用铜粉代替铜片
C.加入MnO2作催化剂
D.将浓硫酸改为稀硫酸
2、简答题 “碘钟”实验中,3I-+S2O
=I+2SO的反应速率可以用I与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃时进行实验,得到的数据如下表:
| 实验编号 | ?① | ?② | ?③ | ?④ | ?⑤
c(I-)/mol?L
0.040
0.080
0.080
0.160
0.160
c(S2O82-)/mol?L
0.040
0.040
0.080
0.020
0.040
t/s
88.0
44.0
22.0
44.0
t2
|
回答下列问题:
(1)该实验的目的是为了探究______因素对化学反应速率的影响.
(2)显色时间t2=______.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)
A.<22.0s?B.22.0~44.0s?C.>44.0s?D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是______.
3、填空题 在一密闭容器中充入1mol H2 和1mol I2,压强为p(Pa),并在一定温度下使其发生反应,
H2(g)+ I2(g)=2HI(g)△H<0(用“加快”、“减慢”、“不变”填空)
(1)保持容器容积不变,向其中加入1molH2,反应速率_________
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率_________
(3)保持容器内压强不变,向其中加入1molN2(N2不参加反应),反应速率_________
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1mol I2(g),反应速率_________
(5)提高起始的反应温度,反应速率_________
4、实验题 (10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。
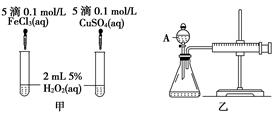
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g) 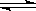 ?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
A.容器内的压强不随时间而变化
B.混合气的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
5、选择题 下列列举的各组事实中存在因果关系的是
[? ]
陈述I(原因)
陈述Ⅱ(结果)
A.
O3能吸收紫外线
大气层中的O3被称为地球保护伞
B.
钠原子核外电子数比铝少
钠的金属性比铝强
C.
盐酸的酸性比氢硫酸强
氯元素的非金属性化碳元素强
D.
N2+3H2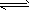 2NH3是放热反应
2NH3是放热反应
工业合成氨的反应在高温下进行