微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 某合成氨厂,日生产能力为30吨,现以NH3为原料生产NH4NO3,若硝酸车间的原料转化率为92%,氨被吸收为NH4NO3的吸收率为98%,则硝酸车间日生产能力应为多少吨才合理?
参考答案:硝酸车间日生产能力为52.76 t才合理。
本题解析:解此题必须注意以下三点:
第一,合成氨厂日生产能力为30吨,现以NH3为原料生成NH4NO3.NH3的用途有两方面:一方面,用NH3氧化制HNO3,另一方面用NH3与制得的HNO3作用制NH4NO3。关键是计划好生产多少吨HNO3,才能使NH3原料最大限度地被利用。HNO3生产少了,则NH3不能全部被HNO3吸收,NH3浪费了,HNO3生产多了,HNO3又浪费了。所以设HNO3日生产能力为x吨,x吨HNO3需用多少吨NH3氧化制得,又可以吸收多少吨NH3生成NH4NO3,通过生产HNO3的数量把氨的两方面用途联系起来。
第二,氨氧化制硝酸中,其关系式如下:
4NH3+5O2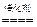 4NO+6H2O
4NO+6H2O
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
此反应中NO是被循环利用的,即NO又被氧化成NO2,再与水作用生成HNO3,因此NO2与水反应的化学方程式应为:
4NO2+2H2O+O2=4HNO3
所以氨氧化制硝酸的关系式如下:
NH3~NO~NO2~HNO3(NH3全部转化成HNO3)
第三,在实际生产过程中,氨不可能100%被氧化生成HNO3,也不可能100%被HNO3吸收生成硝酸铵,题给条件是NH3转化为硝酸的转化率为92%,氨被硝酸吸收的吸收率为98%,在数量关系上,我们必须掌握住一条原则,代入化学方程式的量必须是纯量.
设日产HNO3的质量为x,NH3用于生产HNO3的质量为y.
由各步反应方程式得氨氧化制HNO3的关系为:
NH3~NO~NO2~HNO3
17? 63
y·92%?x
y=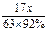
用于被HNO3吸收的NH3质量为(30 t-y):
30 t-y=30 t-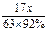
由 NH3?+?HNO3?=? NH4NO3
17 ?63
(30 t-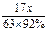 )×98%?x
)×98%?x
得:[30t-17x/(63×92%)]·98%=17x/63
解之得:x=52.76 t。
本题难度:简单
2、实验题 (13分) 某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在”。为此,他们设计了如下图所示的装置。回答下列问题:

(1)写出A中Cu与HNO3反应可能的离子方程式?。?
(2)实验前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是?;装置中B瓶的作用是?。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是?;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”)?的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL? c(H+)=1.0 mol·L-1。假设反应中HNO3 既无挥发也无分解,则:①参加反应的HNO3的物质的量为?mol?
②若已测出反应后E装置的生成物中含氮元素的质量m克,则为确定合金中Cu的质量分数还需测定的数据是?,若测得该数据为n,写出合金中铜的质量(设为x克)的求算式子(只需列式子,不需解方程)?。
(5)为减小上述实验误差,在D中观察到实验现象后还须进行的操作是?。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。只利用A装置中反应后的溶液进行简单的操作,也可以确定合金中Cu的质量分数,其实验操作过程为
?。
参考答案:(1)Cu+4H++ 2NO3-=Cu2++2NO2↑+2H2O?(1分)
3Cu+8H++ 2NO3-=3 Cu2++2NO↑+4H2O?(1分)
(2)把装置中的空气赶走,防止NO被氧化为NO2
(1分)干燥反应中生成的气体(1分)
(3)无色气体变为红棕色(1分)?热(1分)?(4)① 0.5(1分)
②C中烧瓶在实验前后增加的质量(1分)
2x/64+(15-x)/108=3m/14+n/46或2x/64+(15-x)/108="0.5-" m/14-n/46 (2分)
(5)打开K1、K2持续通入一段时间的N2和O2(1分)(不写N2不给分)
(6)在A中加入过量含Cl溶液,过滤后将沉淀洗涤、干燥,最后称取沉淀的质量(2分)
(不写过量扣1分,不写洗涤干燥扣1分)
本题解析:(1)浓硝酸的还原产物是NO2,但由于随着反应的进行,硝酸的浓度逐渐变稀,会生成NO,所以反应的方程式是Cu+4H++ 2NO3-=Cu2++2NO2↑+2H2O、
3Cu+8H++ 2NO3-=3 Cu2++2NO↑+4H2O。
(2)由于装置中含有空气,而空气能把NO氧化生成NO2,从而干扰实验的检验,所以这样操作的目的是赶走装置中的空气,防止干扰实验。由于生成的气体中含有水蒸气,而NO2能和水反应生成NO,从而无法确认铜与硝酸反应是否生成了NO气体,所以B装置的作用是干燥反应中生成的气体。
(3)NO极易被氧气氧化生成红棕色的NO2,所以实验现象是无色气体变为红棕色。由于存在可逆反应2NO2 N2O4,又 91eXaM.org因为该反应是放热反应,所以热的空气可以使平衡 2NO2
N2O4,又 91eXaM.org因为该反应是放热反应,所以热的空气可以使平衡 2NO2 N2O4向逆方向移动,因此NO2浓度增大,从而导致颜色加深,所以应该通入热的氧气。
N2O4向逆方向移动,因此NO2浓度增大,从而导致颜色加深,所以应该通入热的氧气。
(4) ①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0. 5mol。
②要计算铜质量分数,还需要计算出生成的N2O4的质量。所以还需要测量C中烧瓶在实验
(5)由于装置中有残留的气体,所以在D中观察到实验现象后还须进行的操作是:打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽。
(6)由于反应后金属生成了硝酸盐,所以要测定该银圆中铜的质量分数,还需要把金属阳离子变成沉淀,然后通过称量即可计算,所以正确的操作可以是向反应后的溶液中加入足量的盐酸,过滤、洗涤、干燥、称量沉淀的质量。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。化学实验主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求学生必须认真审题,通过联系所学过的知识和技能,灵活运用并进行知识的类比、迁移、重组,全面细致的思考才能作出正确的解答。
本题难度:一般
3、选择题 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体——黑磷,其转化过程如下:白磷 黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是?(?)
黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是?(?)
A.黑磷与白磷互为同分异构体
B.黑磷能导电
C.白磷转化为黑磷是物理变化
D.黑磷能在空气中自燃
参考答案:B
本题解析:白磷和黑磷的分子组成不同,结构也不同,它们是磷的两种不同的单质,互为同素异形体,因此它们的相互转化是化学变化,A、C错;黑磷结构与石墨相似,故能导电;黑磷性质稳定不能在空气中自燃。
本题难度:一般
4、选择题 常温常压下,将盛有20 mL NO2和O2的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有 3 mL气体,则原混合气体中的NO2的体积是(?)
A.17.8mL
B.14.8mL
C.13.6mL
D.12.4mL
参考答案:AC
本题解析:设NO2和O2的体积分别是x、y
x+y="20" mL ①
分两种情况:(1) 剩余O2,则NO2耗尽
4 NO2 + O2 + 2 H2O =" 4" HNO3
x? x/4
所以,y - x/4 =" 3" mL ②
联立①②,得:x =" 13.6" mL,y=" 6.4" mL,故C正确
(2) NO2过量,剩余NO
据3 NO2 + H2O =" 2" HNO3 + NO,得:NO2过量9 mL
4 NO2 + O2 + 2 H2O =" 4" HNO3
4y? y?
则:x - 4y =" 9" mL ③
联立①③,得:x =" 17.8" mL,y=" 2.2" mL,故A正确
本题难度:一般
5、选择题 将可能混有下列物质的硫酸铵样品13.2g在加热条件下,与过量NaOH溶液反应,在标准状况下收集到4.3L气体,则该样品中不可能混有的物质是? (? )
A.NH4HCO3和NH4NO3
B.(NH4)2CO3和NH4NO3
C.NH4Cl和(NH4)2CO3
D.NH4Cl和NH4HCO3
参考答案:C
本题解析:由NH4+→NH3可计算得样品中NH4+的含量为26.2%,再由硫酸铵中NH4+的质量分数27.2%可知其他铵盐中NH4+的质量分数必小于27.2%。现将有关铵盐中NH4+的质量分数计算结果列出:NH4NO3为22.5%、(NH4)2CO3为22.8%、NH4Cl为33.6%、(NH4)2CO3为37.5%,由此可知仅NH4Cl和(NH4)2CO3中NH4+质量分数大于27.2%。故样品中不可能合有的物质是NH4Cl和(NH4)2CO3
本题难度:简单