微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一.最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
(1)以丁烷(C4H10)为汽油代表,这个电池放电时发生反应的化学方程式是______;
(2)这个电池负极发生的反应是:C4H10+13O2--26e-=4CO2+5H2O,正极发生的电极反应方程式是:______;固体电解质里O2-向______极移动;?向外电路释放的电子的电极是______极;
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:______;
(4)汽油燃料电池最大的障碍是氧化反应不完全产生______堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命.
参考答案:(1)燃料电池的总反应和燃料燃烧的化学方程式一致,电池总反应为2C4H10+13O2═8CO2+10H2O,
故答案为:2C4H10+13O2═8CO2+10H2O;
(2)极发生还原反应,总反应减负极反应可得正极反应式,为O2+4e-=2O2-;原电池工作时,阴离子向负极移动,电子从负极经外电路流向正极故答案为:O2+4e-=2O2-;?负;?负;
(3)原电池具有能量利用率高的特点,而燃烧时化学能转变为热能和光能,
故答案为:燃料电池具有较高的能量利用率;
(4)烷不完全氧化会生成碳粒,从而堵塞电极的气体通道,故答案为:碳粒或C.
本题解析:
本题难度:一般
2、选择题 X、Y、Z、M代表四种金属元素、金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为
[? ]
A.X>Y>Z>M
B.X>Z>Y>M
C.M>Z>X>Y
D.X>Z>M>Y
参考答案:B
本题解析:
本题难度:一般
3、选择题 在理论上不能用于设计原电池的化学反应是?(?)
A.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)
C.2FeCl2+Cl2=2FeCl 3
3
D.3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
参考答案:A
本题解析:略
本题难度:简单
4、填空题 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是________________
(2)实验室中现有Na2SO4、CuCl2、MgSO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,
收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4mol/L H2SO 4/mL
| 30
| V1
| V2
| V3
| V4
| V5
|
饱和CuSO4溶液 /mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O /mL
| V7
| V8
| V9
| V10
| 10
| 0
|
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
② 该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
参考答案:(1) CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率 (2分)
(2) CuCl2、(1分)
(3)升高反应温度、适当增大硫酸的浓度、或增加锌的比表面积等(2分)
(4)①30 10 17.5 (3分)
②当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积(2分)
本题解析:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率,因此能起到相似作用的应该是含有铜离子的,所以为氯化铜。影响化学反应速率的因素有,温度,催化剂,浓度,压强,反应物的接触面积。AB应比较的是硫酸铜溶液对该反应的影响。因此硫酸的量应与A的相同,所以V1=30 据表格可知,CDEF应该是呈两倍的关系递增,所以V6="10" 。从图表可知饱和硫酸铜的体积与水的体积之和应为20毫升。所以V9应为20减去2.5等于17.5. :当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降主要是由于当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积
考点:考查影响化学反应速率因素的相关知识。
本题难度:一般
5、选择题 下列说法正确,且能用原电池原理解释的是( )
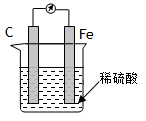
A.合金一定比纯金属耐腐蚀
B.如图,在铁棒上产生气泡,碳棒上没有气泡
C.在锌与稀硫酸反应时,加入硫酸铜溶液可以加快反应速率
D.铝不需要特别处理就具有抗腐蚀能力
参考答案:C
本题解析:合金的耐腐蚀和原电池无关。B中是原电池,但铁作负极,失去电子,碳棒是正极,氢离子在正极得到电子,生成氢气。C中锌把铜离子置换出来生成铜,构成原电池,锌是负极,加快反应速率,正确。铝明白能形成一层致密的氧化膜,从而阻止铝被腐蚀。答案选C。
本题难度:一般