微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 关于锌铜-稀硫酸原电池的叙述,错误的是( )
A.氢离子在铜表面被还原,产生气泡
B.电流从锌片经导线流向铜片
C.电子从锌片经导线流向铜片
D.锌是负极,其质量逐渐减小
参考答案:A.锌作负极、铜作正极,正极上氢离子得电子生成氢气,所以氢离子在铜表面被还原而产生气泡,故A正确;
B.锌作负极、铜作正极,电子从负极锌沿导线流向正极铜,电流从正极铜沿导线流向负极锌,故B错误;
C.锌失电子、铜片上氢离子得电子,所以电子从负极锌沿导线流向正极铜,故C正确;
D.锌易失电子生成锌离子而逐渐被腐蚀,所以其质量逐渐减小,所以锌作负极,故D正确;
故选B.
本题解析:
本题难度:一般
2、填空题 (10分)科学家预言,燃料电池将是2l世纪获得电力的重要途径。一种甲醇燃料电池是采用铂或炭化钨作电极,在硫酸电解液中直接加入净化后的甲醇。同时向一个电极通入空气。
回答如下问题:
(1)配平电池放电时发生的化学反应方程式:
□CH3OH+□O2→□CO2+□H2O
(2)在硫酸电解液中,CH3OH(C为-2)失去电子。此电池的正极发生的反应是 ,负极发生的反应是 。
(3)电解液中的H+向?极移动;向外电路释放电子的电极是?。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其主要有两点:首先燃料电池的能量转化效率高,其次是 。
(5)甲醇燃料电池与氢氧燃料电池相比.其主要缺点是甲醇燃料电池的输出功率较低.但其主要优点是 。
参考答案:(1)2? 3? 2? 4? (2)O2+4H++4e-===2H2O?CH3OH+H2O-6e-===CO2↑+6H+
(3)正 负极 (4)减少污染? (5)甲醇比H2廉价,甲醇是液态(常温下),易于运输和保存
本题解析:(1)甲醇中碳原子是-2价的,氧化产物中碳原子是+4价的,所以1mol甲醇失去6mol电子,而1mol氧气只能得到4mol电子,所以氧化剂和还原剂的物质的量之比是3︰2,所以方程式为2CH3OH+3O2=2CO2+4H2O.
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以氧气再正极通入,甲醇再负极通入。由于是酸性溶液,所以电极反应式分别为)O2+4H++4e-===2H2O、CH3OH+H2O-6e-===CO2↑+6H+。
(3)原电池中阳离子向正极移动,负极失去电子,向外电路释放电子。
(3)由于生成物是水和CO2,没有污染。
(4)由于甲醇比H2廉价,且甲醇是液态(常温下),易于运输和保存。
本题难度:一般
3、选择题 理论上不能设计为原电池的化学反应是
[? ]
A.CH4+2O2 CO2+2H2O?
CO2+2H2O?
B.2H2+O2 2H2O
2H2O
C.HNO3+NaOH=NaNO3+?H2O?
D.2FeCl3+Fe=3FeCl2
参考答案:C
本题解析:
本题难度:简单
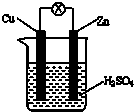
4、选择题 如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.下列叙述正确的是( )
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能