微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
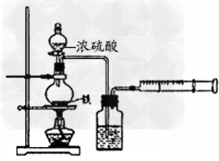
①洗气瓶中浓硫酸的作用是___________。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式?___________________。活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。 ?
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。仪器如下图(可重复使用,可根据需要取用);
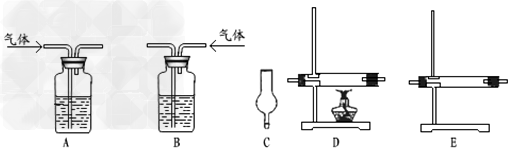
①连接仪器。将装置的字母填入方框内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是___________________。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有____________________________。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe2+可采用的试剂为_____________;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为_________mol。
参考答案:(1)①干燥气体;②2Fe+6H2SO4(浓)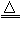 Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
(2)① A-A-A(或C)-D-E-A(或C)或A-A-A-A(或C)-D-E-A(或C)(合理即可);品红溶液-高锰酸钾酸性溶液-浓硫酸(或石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸碱石灰(或:品红溶液-高锰酸钾酸性溶液-高猛酸钾酸性溶液(或品红)-浓硫酸(或碱石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸或碱石灰或:品红溶液-氢氧化钠溶液-高猛酸钾酸性溶液(或品红)-浓硫酸(或碱石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸或碱石灰②?D中固体粉末由黑色变为红色,E中固体由白色变为蓝色)
(3)①混合气体的总体积、反应前后D中粉末质量的差值(反应前D中氧化铜粉末质量反应后D中粉末的质量)(其他合理给分);②? 酸性高锰酸钾溶液;0.1
本题解析:
本题难度:一般
2、填空题 合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为N2 (g) +3H2(g)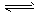 2NH3(g)
2NH3(g)
△H<0。
(1)工业生产时,制取氢气的一个反应为CO(g)+H2O(g)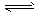 CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。
①T℃时,向1 L密闭容器中充入0.2 mol CO和0.3mol水蒸气,达到平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K=____。
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当重新建立平衡时,水蒸气的总转化率α(H2O)= ________。
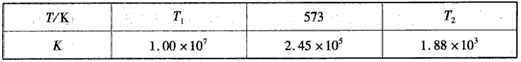
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1____573 K(填“>”、“<”或“=”)。
(3)673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示,下列有关叙述正确的是___(填序号)。

A.c点表示n( NH3)和n(H2)相等
B.c点表示NH3生成的速率与NH3分解的速率相同
C.在e点和d点时,反应的平衡常数相等
D.c点时正反应速率大于逆反应速率
(4)工业上利用NH3制硝酸的过程中有反应:3NO2 +H2O==2HNO3 +NO,从生产流程看,吸收塔中需要补充空气,试分析其原因:___ 。
(5)硝酸厂的尾气中含有氮氧化物,不经处理直接排放会污染空气。目前科学家探索利用气体燃料中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)==4NO(g)+CO2(g) +2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为___。
参考答案:(1)①1; ②50%
(2)<
(3) ACD
(4)充入空气,NO转化为NO2,NO2继续与水反应生成HNO3,有利于提高原料利用率
(5) CH4(g)+2NO2(g)==CO2(g)+2H2O(g)+N2(g) △H= -867 kJ·mol-1
本题解析:
本题难度:一般
3、填空题 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图

已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1mol FeS2放出热量为853 kJ,则FeS2燃烧的热化学方程式为_________________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为______________________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为______________________(任写一个)。
(4)通过“操作I”可以得到亚硫酸钠品体,写出主要操作步骤的名称:______________。
(5)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)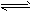 2SO3(g)。研究发现,SO3的体积分数(SO3%) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
2SO3(g)。研究发现,SO3的体积分数(SO3%) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
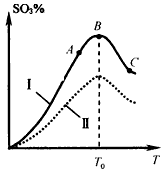
A.该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:vA>vC
C.反应达到B点时,2v正(O2)=v逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线
参考答案:(1)4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s) △H= -3412 kJ/mol
(2)SO2+Na2CO3=Na2SO3+CO2↑(或2SO2+Na2CO3+H2O=NaHSO3+CO2↑)
(3)Fe3++3OH-=Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O)
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC
本题解析:
本题难度:一般
4、选择题 丙烯酸的结构简式为CH2=CH—COOH,其对应的性质中不正确的是(?)
A.与钠反应放出氢气
B.与碳酸氢钠反应
C.能与溴水发生取代反应
D.发生相互加成反应生成高分子化合物
参考答案:C
本题解析:略
本题难度:简单
5、计算题 在催化剂的作用下,乙炔可被氧化为乙二醛,进一步氧化,乙二醛又转化为乙二酸。某工厂生产乙二酸,每日可消耗乙炔气20.0 m3(已折算到标准状况),为监测产品质量,须不断抽样分析。假设某化验员抽取了10.00 g乙二酸产品,然后用6.00 mol·L-1的KOH(aq)进行滴定,达到滴定终点时消耗了碱液36.30 mL。求该工业乙二酸的纯度(已知乙二酸是强酸)。
参考答案:98.0%。
本题解析:乙炔气的日消耗量是干扰因素,与解本题无关。由题意得:
HOOC—COOH+2KOH KOOC—COOK+2H2O
KOOC—COOK+2H2O
90.0 g? 2.00 mol
m(乙二酸)? 6.00 mol·L-1×0.036 30 L
m(乙二酸)=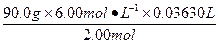 ="9.80" g
="9.80" g
ω(乙二酸)=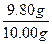 ×100%=98.0%
×100%=98.0%
本题难度:简单