微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验:
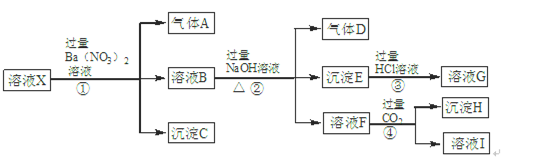
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是?,不能确定是否含有的离子是?,若要确定是否含有这种离子,最可靠方法是:?
?。
(2)溶液I中所含溶质有?(填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是?(填序号)。
(4)步骤①中生成气体A的离子方程式是?。
参考答案:(1)Ba2+、CO32-、SiO32-、NO3- (每个1分,共4分)?Fe3+(1分)
取少量X溶液于试管中,在其中滴加几滴KSCN溶液,若溶液不显血红色则说明没有Fe3+,若显血红色则说明含有Fe3+(2分)
(2)NaNO3、NaHCO3、Ba(NO3)2?(CO2、H2CO3不作要求)(每个1分,共3分) ?
(3)④(1分)?(4)3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O (2分)
本题解析:(1)题干中强酸性溶液中一定不含CO32-、SiO32-;NO3-与Fe2+不能同时存在;根据转化关系中X溶液中加入过量硝酸钡生成气体沉淀和溶液的反应,依据离子性质推断溶液中一定含Fe2+,一定不含NO3?;酸性溶液中硝酸根离子具有强氧化性,加入Ba(NO3)2后得到气体A为NO,D为NO2;沉淀C为硫酸钡,判断溶液中一定含SO42-;根据离子共存判断原溶液中一定不含Ba2+;溶液B中一定含有Fe3+;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+;生成的沉淀E是Fe(OH)3;与碱反应生成的气体D为NH3;溶液F通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-;证明原溶液中一定含有Al3+;沉淀H为Al(OH)3;原溶液中一定含有Al3+、NH4+、Fe2+、SO42-;一定不含Ba2+、CO32-、SiO32-、NO3-;可能含有的Fe3+;用KSCN溶液可检验是否含有Fe3+。
(2)溶液F加入过量的CO2得到的溶液I,一定含有生成的NaHCO3、第①②步剩余和生成的NaNO3和Ba(NO3)2。
(3)①为Ba2+与SO42?反应、NO3?和H+氧化Fe2+;②NaOH与NH4+和Fe3+反应;③为Fe(OH)3与HCl的反应;④为CO2、H2O与AlO2-生成Al(OH)3的反应,所以符合“强酸制弱酸”反应为④。
(4)步骤①中生成气体A为NO3?、H+氧化Fe2+,配平可得离子方程式:)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 。
本题难度:一般
2、选择题 下列有关反应的离子方程式不正确的是
A.向Ba(OH)2溶液中加入少量NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O
B.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH-
C.足量的铁溶于少量的稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
D.向AgCl悬浊液中加入KI溶液振荡,出现黄色沉淀:AgCl(S)+I-?AgI(S)+Cl-
参考答案:B
本题解析:分析:A、碱和酸式盐反应,量少的全部反应,离子方程式中符合化学式的组成比;
B、碳酸钠溶液中碳酸根离子是多元弱酸阴离子,分步水解呈碱性;
C、足量铁反应生成亚铁离子,依据电荷守恒和原子守恒判断;
D、碘化银的溶解度小于氯化银.可以实现沉淀转化;
解答:A、向Ba(OH)2溶液中加入少量NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O,故A正确;
B、向Na2CO3溶液中滴入酚酞溶液,溶液变红,碳酸根离子是多元弱酸阴离子,分步水解呈碱性:CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;故B错误;
C、足量的铁溶于少量的稀硝酸,反应的离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故C正确;
D、向AgCl悬浊液中加入KI溶液振荡,出现黄色沉淀,碘化银溶解度小于氯化银,实现沉淀转化,反应的离子方程式:AgCl(S)+I-?AgI(S)+Cl-,故D正确;
故选B.
点评:本题考查了离子方程式的书写方法和注意问题,注意酸式盐和碱反应量不同产物不同,沉淀转化判断,氧化还原反应的产物判断,题目难度中等.
本题难度:简单
3、选择题 下列两种溶液反应,将第一种溶液滴入第二种溶液与将第二种溶液滴入第一种溶液时发生的反应不完全相同的是?(?)
①AlCl3与NaOH ②AgNO3与氨水 ③Na3PO4与H2SO4 ④NaAlO2与盐酸 ⑤苯酚钠与盐酸
A.①②⑤
B.①②③④
C.②③⑤
D.全部
参考答案:B
本题解析:滴加顺序不同,反应过程中过量的反应物不同,如生成物与过量的反应物可继续反应,则产物就会发生变化。①②③④加入顺序不同,产物都会发生变化,只有苯酚钠跟盐酸反应不受顺序的影响。
本题难度:一般
4、选择题 下列物质中,属于强电解质的是
A.Cu
B.H2O .
C.H2SO4
D.CH3COOH
参考答案:C
本题解析:试题分析:在溶液中完全电离出离子,不存在电离平衡的电解质是强电解质,因此硫酸是强电解质,水和醋酸都是弱电解质。铜是金属,属于单质,不是电解质,也不是非电解质,答案选C。
考点:考查强电解质的判断
点评:该题是高考中的常见考点之一,试题基础性强,注重基础和能力的双向考查。强弱电解质的判断关键是依据溶液中是否存在电离平衡,该题难度不大,学生较易得分。
本题难度:一般
5、选择题 向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中各离子数目也相应地发生变化。溶液中各离子数目与图中四条曲线的对应关系完全正确的是
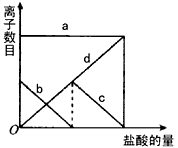
[? ]
a?
b
?c
d
A.
Cl-
K+
CO32-
HCO3-
B.
K+?
CO32-
Cl-
HCO3-
C.
K+?
CO32-
HCO3-
Cl-
D.
K+?
HCO3-
Cl-
CO32-
参考答案:C
本题解析:
本题难度:一般