微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应是吸热反应又是氧化还原反应的是
A.镁与醋酸
B.氯化铵与氢氧化钡晶体
C.制水煤气的反应
D.盐酸与氢氧化钠
2、选择题 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是
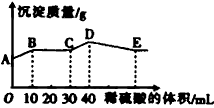
[? ]
A. AB段发生反应的的离子方程式为: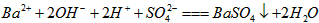
B. BC段发生反应的离子方程式为: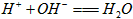
C. D点表示的沉淀的化学式为Al(OH)3、BaSO4
D. E点表示的溶液呈中性
3、选择题 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3 → 3O2↑+ 2Cl2↑+ 4HClO4 + 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:_________→___________(填化学式)。
该反应的氧化产物是____________(填化学式);所得混合气体的平均式量为_______。
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子。反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,该离子反应方程式为____________________________。若将该反应设计成原电池,则在正极生成的离子是___________(填离子名称)
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是_________(填序号)。
a. KMnO4> Cl2? b. Cl2> O2? c. HIO4> HClO3? d. HIO4> Cl2
4、填空题 (15分)某待测液可能有Fe2+、Fe3+、Ag+、Ba2+、Al3+、Ca2+、NH4+等离子,进行了下述实验(所加酸、碱、NH3水、Br2水都是过量的)。

根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由。答_________。
(2)写出化学式:沉淀A_________;沉淀D_________;沉淀E_________。
(3)写出下列离子反应方程式:
溴水氧化溶液A中的某离子:_________。
沉淀C加入足量NaOH溶液后其中一种沉淀溶解:_________。
5、选择题 常温下的下列情况中,一定能大量共存于同一溶液中的离子组是
A.使甲基橙呈红色的溶液中:S2-、Cl-、NO3-、Na+
B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3-
C.由水电离出的c(H+)=1×10 -12 mol·L -1的溶液中:K+、Cl-、NO3-、Na+
D.在0.1mol/L的氯化铁溶液中:Ⅰ一、NH4+、NO3-、Cl-