微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)按要求填空:电负性最大的元素符号 ______;第一电离能最大的元素基态原子核外电子排布式_________;第三周期原子半径最小的元素的价电子排布式______。
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是?;只含有极性键的是?;只含有离子键的是?;既含有非极性键又含有极性键的是?;含有非极性键的离子化合物是?。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的?键更稳定(填“σ”或“π”)。
参考答案:(9分)(1)F? 1s2? 3s23p5?(2)①;②;④;⑤;⑥?(3)π (各1分)
本题解析:(1)非金属性越强,电负性越大,所以电负性最大的是F。He最外层电子数只有2个,稳定性强,第一电离能最大,则基态原子核外电子排布式是1s2。同周期自左向右,原子半径逐渐减小,所以第三周期原子半径最小的元素是氯元素,其价电子排布式是3s23p5。
(2)一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。如果是由同一种非金属的原子之间形成共价键,是非极性键,由不同种非金属的原子之间形成共价键,是极性键,所以只含有非极性键的是氮气;只含有极性键的是水;只含有离子键的是氯化镁;既含有非极性键又含有极性键的是乙烯;含有非极性键的离子化合物是过氧化钠,氢氧化钠是含有离子键和极性键的离子化合物。
(3)氮气中的三键是由1个δ键和2个π键构成的,所以根据N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1可知,π键键能是(942kJ/mol-247kJ/mol)÷2=347.5 kJ/mol>247kJ/mol,所以π键稳定。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用物质结构知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力,提高学生的学科素养。
本题难度:一般
2、选择题 下列各组指定原子序数的元素,能形成AB2型离子化合物的是(?)
A.6和8
B.11和16
C.12和9
D.16和8
参考答案:C
本题解析:A中元素是C和O,可形成共价化合物CO和CO2;B中元素是Na和S,可形成离子化合物Na2S;C中元素是Mg和F,可形成离子化合物MgF2;D中元素是S和O,可形成共价化合物SO2和SO3,所以答案选C。
本题难度:简单
3、选择题 如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说 ?法正确的是
?
A.X的氢化物比R的氢化物稳定
B.原子半径大小顺序是Z>Y>X
C.Y、R形成的化合物YR2能使KMnO4溶液褪色
D.X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构
参考答案:C
本题解析:由图可知,X为第三周期元素且最外层电子数比次外层电子数少3,则X是P元素,R、Y、Z、分别是元素O、S、Cl。A、R的非金属性强于X,所以R的氢化物稳定,错误;B、同周期中,原子半径的大小顺序为X>Y>Z,错误;C、SO2能使KMnO4溶液褪色,正确;D、PCl5中P原子不满足最外层8电子结构,错误,答案选C。
本题难度:一般
4、填空题 短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(l)Y在元素周期表中的位置是__________;X氢化物的电子式是__________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是__________。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如下图所示。
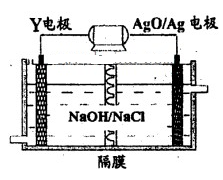
该电池的负极反应式是__________。
(4)Z和W比较,非金属性较弱的是__________(填元素符号),下列可以验证这一结论的是__________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1molH-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
参考答案:(1)第3周期第ⅢA族?
(2)酸? NH4+ + H2O? =? NH3?H2O + H+
(3)Al + 4OH- -3e- = AlO2- + 2H2O
(4)Si? b c d
本题解析:短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性,则X是N元素;Y在元素周期表中所处的周期序数与族序数相等,且Y的原子序数大于X,所以Y是Al元素;Z单质是将太阳能转化为电能的常用材料,则Z是Si元素;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,则W是Cl元素,
(1)Y是Al元素,铝原子核外有3个电子层,最外层有3个电子,所以在元素周期表中位于第三周期第IIIA族,X的氢化物是氨气,其电子式为: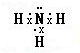 ;
;
(2)氨水和盐酸恰好反应时生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解导致溶液中氢离子浓度大于氢氧根离子浓度而使其水溶液呈酸性;
(3)该装置是原电池,铝作负极,负极上铝失电子发生氧化反应,电极反应式为:
Al+4OH--3e-=AlO2-+2H2O,
(4)硅的非金属性小于氯元素,比较非金属强弱的方法有:其最高价含氧酸的酸性强弱、吸引电子的能力等;
本题难度:一般
5、选择题 2009年国庆庆典天安门广场两侧升起了60只充气式高科技大红灯笼。508所研制的红宫灯外表似灯笼,实际上是内充氦气的“大气球”。下面有关说法错误的是(?)
A.氦元素位于周期表的第18列
B.32He和41He互为同位素
C.42He原子核内中子数为2
D.32He比42He少一个质子
参考答案:D
本题解析:
He质子数为2,A.氦元素位于周期表的第18列.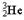 中子数=质量数—质子数=3-2=1,
中子数=质量数—质子数=3-2=1, He与
He与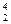 He质子数相同,中子数不同,是氦元素两种不同的原子,互为同位素。
He质子数相同,中子数不同,是氦元素两种不同的原子,互为同位素。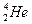 与
与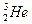 质子数相同,电子数也相同。
质子数相同,电子数也相同。
本题难度:简单