微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方 程式如下:
程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+ 5Cl 2↑+8H2O
5Cl 2↑+8H2O
⑴此反应中氧化剂是?,氧化产物?。若有1mol KMnO4参加反应,转移电
子的物质的量为?。
⑵15.8g KMnO4完全反应,产生的Cl 2在标准状况下的体积为?,有?molHCl
发生反应,有?molHCl被氧化。
⑶若此盐酸的密度为1.2g/cm3,其物质的量浓度为?。
参考答案:(11分)
⑴KMnO 4? Cl2? 5mol(每空1分)
4? Cl2? 5mol(每空1分)
⑵5.6L? 0.8? 0.5(每空2分)
⑶12mol/L(2分)
本题解析:略
本题难度:一般
2、填空题 (17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:____________
②设计实验方案:在不同H2O2浓度下,测定? ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。
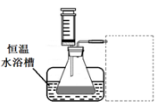
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。

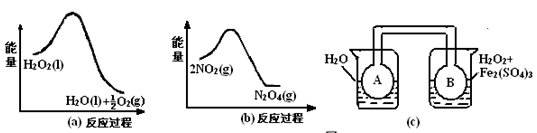
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
参考答案:(1)①
②生成相同体积的氧气所需的时间
③
④测定反应时间
?
H2O2的体积(mL)
0.1mol?L-1Fe2(SO4)3的体积(mL)
加入蒸馏水的体积(mL)
生成O2的体积(mL)
反应时间(min)
实验1
b
a?
c
d
?
实验2
c
a
b
d
?
(2)深;因为过氧化氢分解是放热反应,2NO2(g)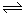 N2O4(g)也是放热反应,所以B瓶温度高于A瓶,温度升高,平衡逆向移动,二氧化氮浓度增大,颜色加深。
N2O4(g)也是放热反应,所以B瓶温度高于A瓶,温度升高,平衡逆向移动,二氧化氮浓度增大,颜色加深。
本题解析:(1)①过氧化氢在硫酸铁作催化剂条件下分解生成水和氧气,过氧化氢既作氧化剂又作还原剂,化学方程式及电子转移方向和数目为
②反应速率是单位时间内物质浓度的改变量,所以测定不同浓度的过氧化氢对分解速率的影响,需测定相同时间内,产生氧气的体积的多少,或生成相同体积的氧气所需时间的多少;
③利用排水量气法,收集一定体积的O2,需要水槽、量筒、导气管,量筒内盛满水倒扣在水槽中,装置如图
④
?
H2O2的体积(mL)
0.1mol?L-1Fe2(SO4)3的体积(mL)
加入蒸馏水的体积(mL)
生成O2的体积(mL)
反应时间(min)
实验1
b
a
c
d
?
实验2
c
a
b
d
?
(2)由图a可知过氧化氢的分解反应是放热反应,由图b可知二氧化氮转化为四氧化二氮的反应也是放热反应,所以装置c中,右侧烧杯B瓶温度高于左侧烧杯A瓶,而温度升高,使平衡2NO2(g)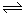 N2O4(g)逆向进行,二氧化氮浓度增大,B瓶的颜色比A瓶的颜色深。
N2O4(g)逆向进行,二氧化氮浓度增大,B瓶的颜色比A瓶的颜色深。
本题难度:一般
3、填空题 建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2
能发生如下反应:
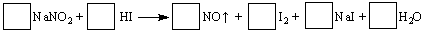
(1)配平上述反应方程式,将系数填入方框中。
(2)上述反应的氧化剂是??,若反应中有5 mol电子转移,则生成NO在标准状况下的体积是???L。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水;②碘化钾淀粉试纸;③淀粉;④白酒;⑤食醋,进行实验,下列几组合适的是?。
A.③⑤
B.①②④
C.①②⑤
D.①②③⑤
参考答案:(1)2NaNO2 + 4HI =2NO + I2 +2 NaI +2 H2O (2)NaNO2;112 (3)C
本题解析:(1)根据得失电子守恒法配平方程式,亚硝酸钠中N为+3价,反应后降为+2价;HI中I为-1价,反应后成为单质升高为0价,所以答案为2NaNO2 + 4HI =2NO + I2 +2 NaI +2 H2O;
(2)氧化剂是元素化合价降低的物质,所以氧化剂是NaNO2;每生成1molNO,则转移1mol电子,若反应中有5 mol电子转移,则生成5molNO,标准状况下的体积是112L;
(3)根据(2)可知,亚硝酸钠在酸性条件下,可以氧化碘离子为碘单质,碘遇淀粉变蓝色,所以选择的一组试剂是C。
本题难度:一般
4、简答题 某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:______;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由______→______.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是______;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)______.
①Cu与HNO3溶液?②Cu与FeCl3溶液?③Fe与HCl溶液?④Zn与H2SO4溶液.
参考答案:(1)当元素处于最高价时只有氧化性,所以Na3AsO4在反应中做氧化剂,对应的产物为Na3AsO3,当元素处于最低价时只有还原性,所以HI在反应中做还原剂,对应的产物为I2,故答案为:
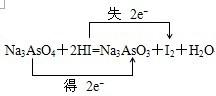
;
(2)当pH<4时,反应从I2→HI,碘元素发生了还原反应,转移电子数目为2mol,则另一个半反应应该是发生了还原反应,即为Na3AsO3→Na3AsO4,转移电子数目为2mol,所以两情况下反应中氧化剂的物质的量之比是1:1,故答案为:Na3AsO3;?Na3AsO4;1:1;
(3)①硝酸是氧化性的酸,铜和浓硝酸反应产生NO2,和稀硝酸反应产生NO,产物和硝酸浓度有关,故①正确;
②铜和三价铁反应只有一种结果生成亚铁和铜离子,和浓度无关,故②错误;
③盐酸是非氧化性的酸,和铁反应生成亚铁盐和氢气,和盐酸浓度无关,故③错误;
④稀硫酸和金属锌反应产生氢气,和浓硫酸反应生成二氧化硫,产物和硫酸浓度有关,故④正确.
故答案为:①④.
本题解析:
本题难度:一般
5、选择题 有下列反应:2KMnO4 + 5K2SO3 + 3H2SO4══ 6K2SO4 + 2MnSO4 + 3H2O ,在反应中还原产物和氧化产物的物质的量之比为
A.1∶4
B.1∶3
C.2∶5
D.3∶2
参考答案:C
本题解析:略
本题难度:简单