| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《影响化学反应速率的因素》高频考点特训(2017年练习版)(二)
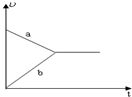 参考答案:对H2(g)+I2(g)? 本题解析: 本题难度:简单 2、选择题 下列说法正确的是 ( ) |
参考答案:A
本题解析:①正确,影响化学反应速率的主要因素是反应物本身的性质;②正确,光为影响反应速率的外因;③错,决定化学反应速率的主要因素为反应物本身性质;④错,压强只能影响有气体参加的反应,对于固体或液体来说,受压强影响很小。
本题难度:一般
3、选择题 下列措施对增大反应速率效果显著的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Cu与浓硝酸的反应中,将Cu片改成Cu粉
参考答案:A.因水为纯液体,改变用量对反应速率无影响,则Na与水反应时增大水的用量,反应速率不变,故A错误;
B.浓硫酸具有强氧化性,改为浓硫酸,反应不生成氢气,故B错误;
C.K2SO4与BaCl2两溶液反应是没有气体参加的化学反应,改变压强,对反应速率无影响,故C错误;
D.Cu片改成Cu粉,增大了接触面积,从而反应速率加快,故D正确;
故选D.
本题解析:
本题难度:简单
4、填空题 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
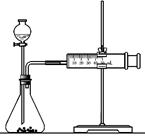
参考答案:23.(1)不同金属与稀硫酸反应的活动性(其他合理也可)。温度
(2)Zn(或Fe)、硫酸(0.5 mol/L、2 mol/L);
产生相同体积气体所需的时间(或相同时间内产生气体的体积)。
本题解析:(1)比较金属性强弱可以用金属与酸反应的剧烈程度及置换出氢气的难易程度来比较。所以该同学的实验目的是,探究不同金属与稀硫酸反应的活动性;因为影响反应速率的外界因素很多,所以在比较金属和酸的剧烈程度及置换氢气的难易程度时,需要控制外界条件相同,因为硫酸的浓度是相同的,所以还应让溶液的温度相同。(2)因为在常温下铁和浓硫酸发生钝化,所以不能选择浓硫酸。粗铁中含有杂质,在溶液中可以构成原电池加快反应速率。所以完成该实验可选用的实验药品是Zn(或Fe)、硫酸(0.5 mol/L、2 mol/L);根据乙同学所用实验装置图可得出,该同学是想利用金属在相同的时间内置换出氢气的多少来比较其金属性强弱的,实验需要测量定时间内产生气体的体积(或产生一定体积的气体所需时间)。
考点:考查探究影响化学反应速率的因素。
本题难度:一般
5、选择题 在室温下,一定量同种规格的铝片分别与下列物质混合,开始时化学反应速率最大的是( )
A.0.25mol?L-1盐酸50mL
B.0.2mol?L-1盐酸12mL
C.0.50mol?L-1盐酸20mL
D.18mol?L-1硫酸15mL
参考答案:A、B、C三者中C的浓度最大,三者比较C的反应速率最大,
但是D为浓硫酸,与铝发生钝化反应而不能生成氢气,
故选C.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《反应速率与.. | |