微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 盐酸与过量铁粉的反应,若有CH3COONa(s,适量)介入,则有
A.反应速率减缓
B.产生氢气的总量不变
C.溶液的pH减小
D.溶液中c(OH-)减小
参考答案:AB
本题解析:Fe与盐酸反应的实质为Fe+2H+═Fe2++H2↑,CH3COONa固体与盐酸反应生成弱电解质CH3COOH,溶液H+离子浓度降低,但不改变氢离子的物质的量A.溶液H+离子浓度降低,反应速率减缓,故A正确;B.氢离子的物质的量不改变,所以产生氢气的总量不变,故B正确;C.溶液H+离子浓度降低,溶液的pH增大,故C错误;D.溶液H+离子浓度降低,溶液中c(OH-)增大,故D错误;故选:AB.
本题难度:一般
2、选择题 用下方法制取氢气,反应速率最大的是
A.冬天,块状的锌与2mol/L稀硫酸溶液反应
B.冬天,粉末状的锌与2mol/L稀硫酸溶液反应
C.夏天,块状的锌与2mol/L稀硫酸溶液反应
D.夏天,粉末状的锌与2mol/L稀硫酸溶液反应
参考答案:D
本题解析:考查外界条件对反应速率的影响。温度越高,浓度越大,反应物的接触面积越大,反应速率越快,所以正确的答案是D。
本题难度:一般
3、选择题 工业生产硫酸时,其中一步反应是2SO2 + O2 ?2SO3,下列说法正确的是
?2SO3,下列说法正确的是
A.增大氧气的浓度不能提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.达到化学平衡时正逆反应速率相等且都为零
参考答案:BC
本题解析:增大反应物的浓度可以加快化学反应速率,故增大氧气的浓度能提高反应速率,所以A错误;温度升高可以加快化学反应速率,所以B正确;使用催化剂可以显著增大反应速率,故C正确;达到化学平衡时正逆反应速率相等为一恒定值,不可能为0,所以D错误,所以本题的答案选BC。
点评:本题考查了化学平衡的知识,该知识点是高考考查的重点和难点,本题要注意的是达到化学平衡时正逆反应速率相等为一恒定值,不可能为0。
本题难度:一般
4、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl 的浓度。影响反应速率的因素是?
的浓度。影响反应速率的因素是?
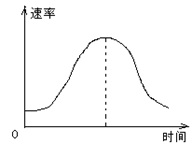 ?
?
A.①④
B.③④
C.①②③
D.②③
参考答案:C
本题解析:图中生成氢气的反应速率先增大后减小,发生的反应为Mg+2H+═Mg2++H2↑。开始反应时浓度最大,随着反应的进行,浓度逐渐减小,如果不考虑气其它因素,反应速率应逐渐减小,但开始阶段反应速率逐渐增大,说明温度对反应速率有影响,因该反应为放热反应,放热使温度升高,则反应速率加快,故③正确;但1随着反应的进行,反应速率开始降低,这是由于反应后期溶液中氢离子的浓度降低,从而导致反应速率降低,即氢离子的浓度对反应速率有影响,即①正确;由反应可知Mg参加反应,开始接触面积大,反应速率快,但随反应的进行,接触面积减小,则反应速率减小,故②正确;因Cl-不参加反应,Cl-的浓度增大或减小都不影响化学反应速率,且该反应中Cl-的浓度不变,故④错误,即影响反应速率的因素为①②③,答案选C。
点评:该题是高考中的常见考点,属于中等难度的试题,侧重对学生分析、归纳和总结问题的能力的培养。明确反应原理和图象中的反应速率变化及影响反应速率的常见因素是解答本题的关键。
本题难度:简单
5、选择题 一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示。下列判断错误的是

A.该实验方案的缺陷之一是未做空白对照实验
B.Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mmol·L-l
C.Fe3+不能提高乙酸降解速率
D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小
参考答案:A
本题解析:A、由于实验目的是研究Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响,所以该实验不必要做空白对照实验,A不正确;B、根据图像可知,Cu2+、Mn2+浓度等于0.1mol/L时乙酸的讲解速率最快,因此Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mmol·L-l ,B正确;C、根据图像可知,随着铁离子的加入,乙酸降解速率反而降低,这说明Fe3+不能提高乙酸降解速率,C正确;D、根据图像可知,铜离子对乙酸的降解速率提高最大,铁离子会降低乙酸的降解速率,因此相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小,D正确,答案选A。
本题难度:一般