|
高考化学知识点总结《离子共存》试题强化练习(2017年最新版)(四)
2017-09-25 18:28:19
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.由水电离产生的C(H+) = 10-13mol/L的溶液中:K+、Na+、SO32-、S2-
B.1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42-
C.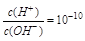 的溶液:K+、Ba2+、NO3-、AlO-2 的溶液:K+、Ba2+、NO3-、AlO-2
D.过量氨水中:Ag+、Na+、K+、NO- 3
|
参考答案:C
本题解析:A、由水电离产生的C(H+) = 10-13mol/L的溶液可能为酸性,也可能为碱性,酸性时,H+与SO32?、S2?反应,不能大量共存,故A错误;B、1.0 mol·L-1KNO3溶液,NO3?、H+与Fe2+发生氧化还原反应,不能大量共存,故B错误;C、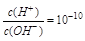 的溶液呈碱性,各离子互不反应,能大量共存,故C正确;D、NH3?H2O与Ag+反应,不能大量共存,故D错误。 的溶液呈碱性,各离子互不反应,能大量共存,故C正确;D、NH3?H2O与Ag+反应,不能大量共存,故D错误。
考点:本题考查离子共存。
本题难度:一般
2、选择题 在pH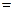 1的溶液中,能大量共存的一组离子或分子是 1的溶液中,能大量共存的一组离子或分子是
A.Mg2+、Na+、ClO-、NO3-
B.Al3+、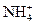 、 、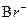 、C1- 、C1-
C.K+、Cr2O72-、CH3CHO、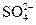
D.Na+、K+、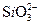 、C1- 、C1-
参考答案:B
本题解析:略
本题难度:简单
3、选择题 在无色透明的溶液中,可以大量共存的离子组是( )
A.NH4+、Cu2+、Cl-、NO3-
B.K+、Na+、SO42-、Cl-
C.K+、Na+、CO32-、Ca2+
D.Ba2+、Fe3+、SO42-、OH-
参考答案:A.该组离子之间不反应,则能够共存,但Cu2+为蓝色,与无色溶液不符,故A错误;
B.因该组离子之间不反应,则能够共存,且离子均为无色,故B正确;
C.因CO32-、Ca2+能结合生成沉淀,则不能共存,故C错误;
D.因Fe3+、OH-能结合生成沉淀,Ba2+、SO42-能结合生成沉淀,则不能共存,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 在pH=1的溶液中能大量共存的一组离子或分子是( )
A.Na+、Mg2+、ClO-、NO3-
B.Al3+、NH4+、Br-、Cl-
C.K+、Cr2O72-、CH3CHO、SO42-
D.Na+、K+、SiO32-、Cl-
参考答案:A、酸性环境下ClO-与H+反应生成弱电解质次氯酸,故A错误;
B、酸性条件下,Al3+、NH4+、Br-、Cl-之间都不发生反应,故B正确;
C、在酸性条件下Cr2O72-与CH3CHO发生氧化还原反应而不能大量共存,故C错误;
D、SiO32-与H+反应生成弱电解质硅酸,且硅酸难溶于,故D错误.
故选B.
本题解析:
本题难度:简单
5、实验题 (6分)某同学进行如下实验:
向盛有10滴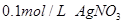 溶液的试管中滴加 溶液的试管中滴加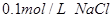 溶液,至不再有白色沉淀生成。向其中滴加 溶液,至不再有白色沉淀生成。向其中滴加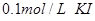 溶液;再向其中滴加 溶液;再向其中滴加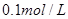 的 的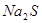 溶液。 溶液。
请回答:
(1)白色沉淀是 ,证明“不再有白色沉淀生成”的操作是 。
(2)能说明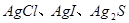 溶解度依次减小的现象为 。 溶解度依次减小的现象为 。
(3)滴加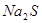 溶液后发生反应的离子方程式是 。 溶液后发生反应的离子方程式是 。
参考答案:(1)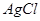 1分 1分
静置后取上层清液,加入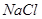 溶液,若不出现白色沉淀,证明 溶液,若不出现白色沉淀,证明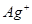 已经沉淀完全。 已经沉淀完全。
(表述合理即可得分) 1分
(2)白色沉淀转化为黄色,黄色沉淀转化为黑色 2分
(3)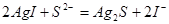 2分 2分
本题解析:(1)硝酸银和氯化钠反应生成氯化银白色沉淀。要验证沉淀是否完全,可以取水层清液,继续滴加氯化钠溶液,若不出现白色沉淀,证明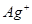 已经沉淀完全,反之则没有沉淀完全。 已经沉淀完全,反之则没有沉淀完全。
(2)沉淀转化的实质是向生成更难溶的方向进行,所以如果加入碘化钾,则白色沉淀转化为黄色沉淀碘化银。如果继续加入硫化钠,则黄色沉淀转化为黑色硫化银。
(3)根据反应物的生成物可写出该反应的方程式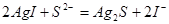 。 。
本题难度:一般
|