微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一个原电池的总反应的离子方程式是:Zn+Cu2+═Zn2++Cu,该反应的原电池的正确组成是( )
A.正极:Zn 负极:Cu 电解质溶液:CuCl2
B.正极:Zn 负极:Cu 电解质溶液:ZnCl2
C.正极:Cu 负极:Zn 电解质溶液:CuSO4
D.正极:Cu 负极:Zn 电解质溶液:ZnSO4
参考答案:该原电池发生的反应为Zn+Cu2+═Zn2++Cu,锌失电子发生氧化反应,所以作负极,
铜离子得电子发生还原反应,所以应为正极上的反应,故铜作正极,
电解质溶液是含有发生发生还原反应离子的电解质溶液,即溶液中必定含有铜离子,
故选C.
本题解析:
本题难度:一般
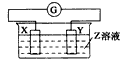
2、选择题 X、Y两根金属棒插入Z溶液中构成下图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的
?[? ]
?
X
Y
?Z
A.
Zn?
Cu
? 稀硫酸
B.
Cu?
Zn
? 稀硫酸
C.
Cu
Ag
? 硫酸铜溶液
D.
?Ag?
Zn
? 硝酸银溶液
参考答案:D
本题解析:
本题难度:一般
3、选择题 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是(?)
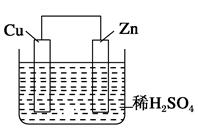
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1 mol电子流过导线,则产生的H2为0.5 mol;
⑥正极的电极反应式为Zn-2e-=Zn2+
A.①②③
B.③④⑤
C.④⑤⑥
D.②③④
参考答案:B
本题解析:在该原电池中,Zn比Cu活泼,故Zn作负极,Cu作正极,电子由Zn流出经导线流向Cu;负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,故每转移1 mol电子时,产生0.5 mol H2;在溶液中H+向正极移动,SO向负极移动。故①②⑥错误,③④⑤正确,选B项。
本题难度:简单
4、选择题 下列装置或操作能达到相应实验目的是( )
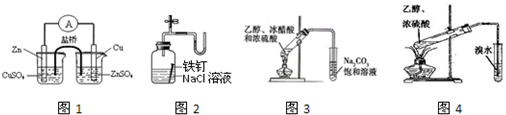
A.图1构成锌-铜原电池
B.图2证明铁生锈与空气有关
C.图3制备乙酸乙酯
D.图4证明乙醇发生消去反应生成了乙烯
参考答案:A.图1应为
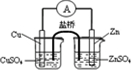
,可构成原电池,故A错误;
B.铁在NaCl溶液中发生吸氧腐蚀,瓶内压强减小,水柱左边高,可证明,故B正确;
C.制备乙酸乙酯,导管不能插入液面以下,防止倒吸,故C错误;
D.乙醇易挥发,能与溴水发生氧化还原反应,不能证明生成乙烯,故D错误.
故选B.
本题解析:
本题难度:简单
5、填空题 天然气、煤炭气(CO、H2)的研究在世界上相当普遍。其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势。主要反应为:
①CH3OCH3(g) +H2O(g) 2CH3OH(g)?△H= 37Kj·mol-1 2CH3OH(g)?△H= 37Kj·mol-1
②CH3OH(g)+H2O(g)  3 H2(g)+CO2(g)?△H =49Kj·mol-1 3 H2(g)+CO2(g)?△H =49Kj·mol-1
③CO2(g) +H2(g)  CO(g) +H2O(g)?△H=41.3Kj·mol-1 CO(g) +H2O(g)?△H=41.3Kj·mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响。
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为?。
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为 ?。
(3)下列采取的措施和解释正确的是?。(填字母序号)
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为:
CO (g) +2H2(g)  CH3OH(g)?△H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率( CH3OH(g)?△H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率( )与温度、压强的关系如下图所示。 )与温度、压强的关系如下图所示。
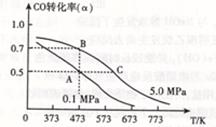
①自反应开始到达平衡状态所需的时间tA?tB(填“大于”、“小于”或“等于”)。
②A、C两点的平衡常数KA?KC(填“大于”、“小于”或“等于”)。
(5)某工作温度为650oC的熔融盐燃料电池,是以镍合金为电极材料,负极通人煤炭气(CO、H2),正极通人空气与CO2的混合气体,用一定比例的Li2CO3和Na2CO3混合物做电解质。请写出正极的电极反应式?____?。
参考答案:(1)3CH4+CO2→2CH3OCH3?
(2)CH3OCH3(g) +3H2O(g)  6H2(g)+2CO2(g)?△H= 135kJ·mol-1 6H2(g)+2CO2(g)?△H= 135kJ·mol-1
(3) ABD?(4)①大于?②大于?(5)O2+4e-+2CO2= 2CO32-
本题解析:本题是有关化学反应原理的综合题。(1)根据原子守恒书写方程式;(2)给出的三个方程式中第③是副反应,所以CH3OCH3(g)与水蒸气制氢气的热化学方程式应是①+2②得到,△H也这样计算。
CH3OCH3(g) +3H2O(g) 6H2(g)+2CO2(g)?△H= 135kJ·mol-1 6H2(g)+2CO2(g)?△H= 135kJ·mol-1
(3)A、反应③是吸热反应,降低温度平衡逆向移动,减少CO的产生,正确;B、对反应①、②来说,水是反应物,增加进水量,促进二甲醚的转化;对于反应③,水是生成物,增加水的量会抑制该反应正向进行,减少CO的产生,正确;C、催化剂不能改变反应物的转化率,只能改变反应速率,错误;D、增大压强对于反应②逆向移动,制取的氢气量减少,但对于反应③,增大压强水的浓度增大,使平衡逆向移动,减少CO的产生,正确。(4)B点压强大,反应速率快,先达到平衡,用时少;K只和温度有关,温度高,该反应逆向移动,K值大,所以KA大于KC;书写电极反应式时要确定正极反应物和产物,要明确介质,确定氧的存在微粒。
本题难度:困难
|