微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某溶液中含有NO、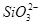 、
、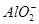 、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
A.只有S2-
B.S2-和NO3-
C.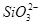 、S2-和NO3-
、S2-和NO3-
D.4种离子都减少
参考答案:B
本题解析:本题通过实验探究4种离子的反应情况,考查离子反应的本质。解答时根据H+、Cl-、Na+、OH-与4种离子的性质,推断出离子数目大量减少的离子。加入过量盐酸,NO3- (H+)氧化S2-,从而导致 NO3-和S2-的数目大量减少,而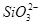 、
、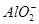 与过量的H+反应生成H2SiO3、Al3+,H2SiO3、Al3+分别与过量的OH-反应又生成
与过量的H+反应生成H2SiO3、Al3+,H2SiO3、Al3+分别与过量的OH-反应又生成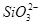 和
和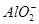 ,数目几乎不变。
,数目几乎不变。
本题难度:一般
2、选择题 某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是
A.加入的酸过量
B.生成的盐不水解
C.酸和碱等物质的量混合
D.反应后溶液中c(A-)=c(M+)
参考答案:D
本题解析:一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,则有c(OH-)=c(H+),如HA为强酸,则物质的量相等,如HA为弱酸,则碱应过量,以此进行分析。A、如HA为强酸,则物质的量相等,故A错误;B、如HA为强酸,,则生成强酸强碱盐,不会水解,故C错误;C、如HA为弱酸,则酸物质的量应过量,混合前酸与碱中溶质的物质的量不等,故B错误;D、溶液呈中性,则有c(OH-)=c(H+),根据溶液电中性原则可知c(A-)=c(M+),故D正确,故选D。
点评:本题考查酸碱混合的计算或判断,题目难度不大,明确碱的强弱是解答本题的关键,并注意电荷守恒的应用来解答。
本题难度:一般
3、填空题 有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、 、
、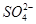 、Cl-、I-、
、Cl-、I-、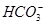 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
实验步骤
| 实验现象
|
①取少量该溶液,加几滴甲基橙溶液
| 溶液变红色
|
②取少量该溶液,加入铜片和浓硫酸,加热
| 有无色气体产生,遇空气可以变成红棕色
|
③取少量该溶液,加入BaCl2溶液
| 有白色沉淀生成
|
④取③中的上层清液,加入AgNO3溶液
| 有稳定的白色沉淀生成,且不溶于稀硝酸
|
⑤取少量该溶液,加入NaOH溶液
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解
|
由此判断:
(1)溶液中一定存在的离子是?;溶液中肯定不存在的离子是?。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)?。
(3)写出实验⑤中所有反应的离子方程式:?。
参考答案:(1) 、
、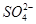 、Mg2+、Al3+Fe2+、
、Mg2+、Al3+Fe2+、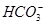 、I-、Ba2+
、I-、Ba2+
(2)K+的检验可以用焰色反应;Cl-的检验:向溶液中加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,再加稀硝酸,若生成白色沉淀不溶解,则证明有Cl-
(3)H++OH-=H2O Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=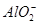 +2H2O
+2H2O
本题解析:原溶液无色,则其中不含有Fe2+;实验①说明溶液呈酸性,所以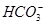 不能大量存在;实验②说明溶液中含有
不能大量存在;实验②说明溶液中含有 ,因为I-能被HNO3氧化,所以I-不能大量存在;实验③说明原溶液中含有
,因为I-能被HNO3氧化,所以I-不能大量存在;实验③说明原溶液中含有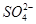 ,则肯定不含Ba2+;实验④无法说明原溶液中是否含有Cl-,因为实验③引入了Cl-;实验⑤说明溶液中含有Mg2+和Al3+。
,则肯定不含Ba2+;实验④无法说明原溶液中是否含有Cl-,因为实验③引入了Cl-;实验⑤说明溶液中含有Mg2+和Al3+。
本题难度:一般
4、选择题 下列有关判断正确的是(?)
A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+)
B.能使紫色石蕊试液呈红色的溶液:Na+、NH、I-、NO可以大量共存
C.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L
D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-= CO32- + H2O
参考答案:A
本题解析:A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+)符合质子守恒。正确。B.能使紫色石蕊试液呈红色的溶液是酸性溶液。此时会发生反应:8H++6I-+2NO=3I2+2NO↑+ 4H2O不能大量共存。错误。C.在室温下 pH=13的氢氧化钠溶液中:c(OH-)=Kw÷c(H+)=10-14÷10-13=0.1mol/L.水的电量是吸热过程。若是升高温度,则促进水的电离,Kw增大。c(OH-)>0.1mol/L。错误。D.NH4HCO3溶于过量的NaOH溶液中发生反应:HCO3-+ NH4++ 2OH-= CO32- + 2H2O+NH3↑。错误。
本题难度:一般
5、选择题 在下列溶液中,各组离子一定能够大量共存的是
A.常温下,c(H+)/c(OH-)=1010的溶液:Na+、NH4+、SO42-、CH3COO-
B.滴入酚酞试液显红色的溶液:Na+、Ba2+、NO3-、Cl-
C.由水电离出的c(H+)=1×10-13mol/L的溶液:NH4+、K+、CO32-、Cl-
D.含有大量HCO3-的溶液:K+、Al3+、Cl-、Na+