| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《离子方程式的书写及正误判断》高频试题强化练习(2017年最新版)(六)
参考答案: 本题解析: 本题难度:一般 3、选择题 下表中评价合理的是 参考答案:B 本题解析:A、硝酸与金属或还原性物质反应不能生成氢气,错误;B、离子方程式中难溶物质写化学式,碳酸镁是不溶物,写不能拆分,正确;C、漏写了铵根和氢氧根离子的反应,错误;D、Fe2+还原性强于Br-,Fe2+先于氯气反应,该反应氯气不足但可以根据Fe2+与 Cl2的计量数关系判断出方程式正确,错误。 本题难度:一般 4、选择题 下列离子方程式中,只能表示一个化学反应的是 |
参考答案:C
本题解析:①Zn+Cu2+ ==Zn2++Cu,表示Zn与可溶性铜盐的反应;② Ag++Cl-="=" AgCl↓,表示AgNO3与可溶性氯化物或盐酸反应;③Cl2+H2O H++Cl-+HClO只能是氯气与水的反应;④CO32-+2H+ ="=" CO2↑+H2O表示可溶性碳酸盐与盐酸或稀硫酸的反应,选C。
H++Cl-+HClO只能是氯气与水的反应;④CO32-+2H+ ="=" CO2↑+H2O表示可溶性碳酸盐与盐酸或稀硫酸的反应,选C。
考点:考查离子方程式改写成化学方程式。
本题难度:一般
5、填空题 按图的装置连接好仪器,先在烧杯中加入20mL左右的Ba(OH)2溶液,接通电源后,逐渐滴加稀硫酸至过量。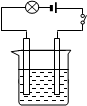
(1)当逐渐滴加稀硫酸时,烧杯中观察到的现象是: 。
(2)灯泡的现象是: ;原因是: 。
(3)发生反应的离子方程式为:
参考答案:(1)生成白色沉淀
(2)先变暗后变亮 Ba(OH)2和H2SO4先发生反应使离子浓度减小,然后H2SO4过量离子浓度增大
(3)Ba2++SO42-+ 2OH-+2H+= BaSO4↓+2H2O
本题解析:向Ba(OH)2溶液中,逐滴加入稀硫酸,先生成BaSO4沉淀,溶液的导电性减弱,所以灯泡先变暗;稀硫酸过量时,溶液中H+和SO42-浓度增大,灯泡又变亮。
考点:离子反应方程式。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《醇》高频考.. | |