微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
参考答案:(1)2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1(热化学方程式和反应热各1分)
(2)318.1 kJ(未写单位不得分)
(3)N2H4-4e-+4OH- = N2+4H2O O2+4e-+2H2O = 4OH-
(4)2NH3+ClO-= N2H4+Cl-+H2O
本题解析:(1)已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。则2mol液态肼放出的热量为219.3 kJ×5=1096.5 kJ
所以反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
所以有反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(l) ΔH=-1272.5kJ·mol-1
16 g气态肼的物质的量="16g/32g/mol=0.5mol," 放出的热量Q=1272.5 kJ /4="318.1" kJ
(3)由肼和空气构成的碱性燃料电池的负极反应式为:N2H4-4e-+4OH- = N2+4H2O 正极反应式为:O2+4e-+2H2O = 4OH-
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼, 次氯酸钠是氧化剂,被还原为氯化钠,氨气做还原剂,被氧化为肼。2NH3+ClO-= N2H4+Cl-+H2O
考点:热化学方程式的书写,电极反应式的书写。
本题难度:一般
2、填空题 (12分)(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 ;
若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极。
(2)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:
2PbSO4 + 2H2O Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4
铅蓄电池放电时, (填物质名称)在负极发生反应。放电过程中硫酸浓度由5mol/L下降到 4mol/L,电解液体积为2000mL(反应过程溶液体积变化忽略不计);求放电过程中外电路中转移电子的物质的量为 mol。
(3)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:
正极:
参考答案:(1)2Fe3++Cu=2Fe2++Cu2+ 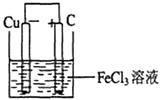
(2)铅 2 (3)CH4+10 OH
本题解析:
本题难度:困难
3、选择题 能将化学能转化为电能的装置(溶液均为稀硫酸)是
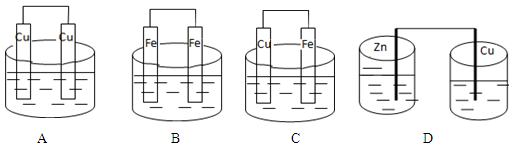
参考答案:C
本题解析:形成原电池的四个条件:1.活泼些不同的电极材料。2.电解质溶液3.形成闭合回路4.自发进行的氧化还原反应。AB选项电极材料相同。D选项不能形成闭合回路,所以答案选C
本题难度:一般
4、选择题 下列各个装置中能组成原电池的是( )
A.
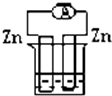
稀硫酸
B.
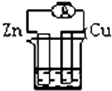
CuSO4溶液
C.
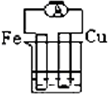
酒精溶液
D.
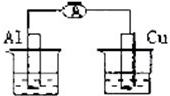
? 稀硫酸? 稀硫酸
参考答案:A、两电极的活泼性相同,所以不能构成原电池,故A错误;
B、符合原电池的构成条件,所以能构成原电池,故B正确;
C、酒精是非电解质,该装置不能自发的进行氧化还原反应,所以不能构成原电池,故C错误;
D、该装置不能形成闭合回路,所以不能构成原电池,故D错误;
故选B.
本题解析:
本题难度:一般
5、选择题 如图关于甲、乙、丙、丁四幅图说法正确的是( )
A.装置甲中对于铁闸门的保护用的是“牺牲阳极的阴极保护法”,焊接在铁闸上的金属R可以是锡块
B.装置乙中对于铁闸门的保护采用的是“外加电流的阴极保护法”,铁闸门应与直流电源的负极相连
C.装置丙可实现电解精炼铜,电极A的材料用纯铜,电极B的材料用粗铜
D.装置丁可实现镀铜,铜片接在电源的正极,待镀金属接在电源的负极,X溶液应用含有待镀金属阳离子的溶液
参考答案:A、Sn与Fe构成原电池时,Fe作负极被腐蚀,所以装置甲中对于铁闸门的保护用的是“牺牲阳极的阴极保护法”,焊接在铁闸上的金属R不能是锡块,可以是比Fe活泼的金属,如Zn、Mg,故A错误;
B、Fe与外接电源相连,作阴极被保护,所以装置乙中对于铁闸门的保护采用的是“外加电流的阴极保护法”,铁闸门应与直流电源的负极相连,作阴极被保护,故B正确;
C、电解精炼时纯铜作阴极,粗铜作阳极,所以装置丙不能实现电解精炼铜,电极A的材料应用粗铜,电极B的材料用纯铜,故C错误;
D、电镀时,镀层金属作阳极,待镀金属作阴极,所以装置丁可实现镀铜,铜片接在电源的正极,待镀金属接在电源的负极,X溶液应用含有待镀金属阳离子的溶液,故D正确;
故选BD.
本题解析:
本题难度:一般