微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)已知在0.1mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:[Na+]>[HSO3-]>[SO32-]>[H2SO3]。则:
(1)则该溶液中[H+]____[OH-](填“<”“>”“=”),简述理由(用离子方程式表示)____。
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的氢氧化钠溶液,可观察到的现象是_____________________;写出该反应的离子方程式_________________。
参考答案:(1)>。在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-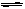 H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O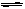 H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
(2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
本题解析:(1)在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-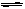 H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O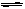 H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,因此溶液显酸性,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,因此溶液显酸性,所以可确定[H+]>[OH-]。
(2)HSO3-结合OH-的能力大于NH4+结合OH-能力,所以当氢氧化钠少量时,HSO3-和氢氧化钠反应,NH4+不反应,所以现象是含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
本题难度:一般
2、选择题 用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是?(?)
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)> c(OH-)
参考答案:C
本题解析:A正确,当盐酸刚开始滴入时有c(NH4+)>c(Cl-),c(OH-)>c(H+);B正确,当溶液呈中性时有c(NH4+)=c(Cl-),c(OH-)=c(H+);C错,由电荷守恒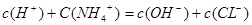 可知,滴定过程中不可能出现c(Cl-)>c(NH4+),c(OH-)>c(H+);D正确,当盐酸过量时有c(Cl-)>c(NH4+),c(H+)> c(OH-)
可知,滴定过程中不可能出现c(Cl-)>c(NH4+),c(OH-)>c(H+);D正确,当盐酸过量时有c(Cl-)>c(NH4+),c(H+)> c(OH-)
本题难度:一般
3、选择题 物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH 分别为8、9、10,则这三种一元酸的酸性由强到弱的顺序为
A.HX>HY>HZ
B.HX>HZ>HY
C.HZ>HY>HX
D.HY >HX>HZ
参考答案:A
本题解析:形成钠盐的酸越弱,相应的钠盐越容易水解,溶液的碱性越强。所以根据三种一元酸的钠盐NaX、NaY、NaZ溶液的pH 分别为8、9、10可判断,酸性强弱顺序是HX>HY>HZ,答案选A。
点评:影响盐类水解的根本性因素是形成盐的酸碱性强弱,即越弱越水解。
本题难度:一般
4、选择题
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COOH)+c(CH3COO-)=0.02 mol·L-1
参考答案:AD
本题解析:溶液中存在下述两个平衡:
CH3COOH CH3COO-+H+?①
CH3COO-+H+?①
CH3COO-+H2O CH3COOH+OH-?②
CH3COOH+OH-?②
溶液中离子为Na+、CH3COO-、H+、OH-,由溶液呈电中性可得c(Na+)+c(H+)=c(CH3COO-)+c(OH-);因为已知c(CH3COO-)>c(Na+),可得c(H+)>c(OH-),A正确;由此推出平衡①是主要的,c(CH3COO-)>c(CH3COOH),C不正确;由平衡①②可知c(CH3COOH)和c(CH3COO-)之和为定值,即0.02 mol·L-1,所以D正确。
本题难度:简单
5、选择题 NH4Cl溶液的pH和稀盐酸的pH均为5,其中由水电离出的c(H+)分别为xmol·L-1和ymol·L-1。则下列x和y的关系正确的是()
A.x=104y
B.x=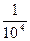 y
y
C.x="y"
D.不能确定
参考答案:A
本题解析: 水解:
水解: +H2O
+H2O NH3·H2O+H+,破坏了水的电离平衡,使其电离程度增大,溶液显酸性,pH=5,x=c(H+)=10-5mol·L-1;而HCl溶液中水的电离遭到抑制,pH=5,c(H+)=10-5mol·L-1,y=c水(H+)=c水(OH-)=
NH3·H2O+H+,破坏了水的电离平衡,使其电离程度增大,溶液显酸性,pH=5,x=c(H+)=10-5mol·L-1;而HCl溶液中水的电离遭到抑制,pH=5,c(H+)=10-5mol·L-1,y=c水(H+)=c水(OH-)=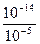 mol·L-1=10-9mol·L-1,则有x=104y。故选A。
mol·L-1=10-9mol·L-1,则有x=104y。故选A。
本题难度:简单