微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺.这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等.该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气.合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜.下列关于铝、镓的说法正确的是( )
A.铝的金属性比镓强
B.铝的熔点比镓低
C.Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D.铝、镓合金与水反应后的物质可以回收利用冶炼铝
参考答案:A、同主族元素从上到下金属性逐渐增强,金属性Ge>Al,故A错误;
B、二者都是金属晶体,离子半径Ge3+>Al3+,故金属Al中的金属键更强,故熔点Al>Ge,故B错误;
C、Ga的金属性比Al强,Ga(OH)3可能不表现为两性氢氧化物,故Ga(OH)3不一定与能与NaOH溶液反应,故C错误;
D、铝镓合金与水反应,铝生成氧化铝,可以回收氧化铝冶炼铝,故D正确;
故选D.
本题解析:
本题难度:一般
2、填空题 下图是元素周期表的结构简图,据图回答下列问题:

(1)上表中全部属于金属元素的区域是___(填字母)。
(2)现有甲、乙两种元素,甲属于非金属,其单质在室温下呈液态,乙元素原子核外第三层比第二层上的电子数少1个。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,非金属性较强的是___ (填元索符号),可以验证该结论的实验是___(填字母)。
a.相同条件下,比较这两种单质在水中的溶解度
b.将这两种元素的单质分别和同浓度的NaOH溶液反应
c.将乙的单质加入到甲的钠盐溶液中,观察现象
d.比较这两种元素的气态氢化物的稳定性
参考答案:(1)B
(2)①甲位于第四周期ⅦA族,乙位于第三周期ⅦA族,分?别是Br、Cl(图略);?②Cl;cd
本题解析:
本题难度:一般
3、推断题 下图是元素周期表的一部分,元素A的最外层电子数为5,D的最高价氧化物对应水化物0.98g 跟1.12g氢氧化钾完全反应,在D的原子核中,中子数和质子数相等。
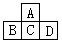
(1)元素名称:A_____ B____ C_____ D______ 。
(2)用电子式表示D的氢化物的形成过程:_____。
(3)B、C、D最高价氧化物对应水化物的酸性由弱到强的顺序是(用化学式表示)_____ 。
(4)A、B、C的气态氢化物的稳定性由强到弱的顺序是(用化学式表示)_____。
参考答案:(1)氮;硅;磷;硫
(2)答案(略)
(3)H2SiO3<H3PO4<H2SO4
(4)NH3>PH3>SiH4
本题解析:
本题难度:一般
4、选择题 下列关于元素周期律的叙述正确的是
A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现
B.元素的性质随着原子序数的递增而呈周期性的变化
C.随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现
D.元素性质的周期性变化是指原子核外电子排布的周期性变化,原子半径的周期性变化及元素主要化合价的周期性变化
参考答案:B
本题解析:随着元素原子序数的递增,原子最外层电子数K层从1到2;随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-4到-1重复出现;元素的金属性和电负性等也是元素的性质,也会出现周期性的变化.
本题难度:简单
5、选择题 根据中学化学教材所附元素周期表判断,下列叙述不正确的是
[? ]
A.若周期表中第七周期完全排满共有32种元素
B.周期表中共有18个列,其中形成化合物种类最多的在第14列
C.除过渡元素外周期表中最外层电子数相同的元素都位于同一族中
D.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
参考答案:C
本题解析:
本题难度:简单