| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《电解池原理》高频考点强化练习(2017年最新版)(八)
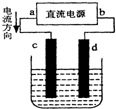 参考答案:在电解池中,电流的流向和电子的移动方向相反,电流是流向阳极,所以c是阳极,d是阴极,a是正极,b是负极. 本题解析: 本题难度:一般 4、选择题 某温度时,用惰性电极电解硝酸钠的不饱和溶液.若两极板收集到气体总体积为22.4aL时,剩余溶液恢复至原温度,析出溶质mg(溶质不带结晶水);若两极收集到气体总体积为33.6aL时,剩余溶液恢复至原温度,析出溶质ng.则硝酸钠在该温度时的溶解度是(气体体积均已折合为标准状况下的体积)( )
B.
C.
D.
参考答案:用惰性电极电解硝酸钠的不饱和溶液.若两极板收集到气体总体积为22.4aL时,阳极反应生成氧气,阴极生成氢气,水中是电解水,氧气和氢气物质的量之比为1:2,所以22.4aL气体物质的量为amol,其中氧气13amol,氢气23amol,电解水物质的量为23amol;同样若两极收集到气体总体积为33.6aL时,气体为氧气和氢气混合物物质的量为1.5amol,其中氧气13×1.5a=0.5amol,氢气为23×1.5a=amol,电解水物质的量为amol;第一次析出溶质mg,第二次剩余溶液恢复至原温度,析出溶质ng,实质是(n-m)g晶体溶解在两次电解水的质量差中会形成饱和溶液,两次电解的水物质的量的差值为amol-23amol=13amol,质量为=13amol×18g/mol=6ag,即6ag水溶解(n-m)g晶体形成饱和吸收钠溶液,根据溶解度S的概念计算:6a:(n-m)=100:S,S=100(n-m)6ag; 本题解析: 本题难度:一般 5、填空题 加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。 参考答案:(1)5I- + IO3- + 6H+= 3I2 + 3H2O 本题解析:(1)KIO3与盐酸酸化的淀粉KI溶液发生氧化还原反应生成碘单质,遇淀粉变蓝,离子反应为5I-+IO3-+6H+=3I2+3H2O,故答案为:5I-+IO3-+6H+=3I2+3H2O; 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质结构和.. | |