微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段.下列叙述正确的是( )
A.阴极自始自终只析出H2
B.溶液pH不断增大,最后为7
C.电解最后阶段为电解水
D.阳极先析出Cl2,后极出O2
参考答案:可以将溶质看成3molNaCl和1molH2SO4,再转化一下思想,可以看成2molHCl,1molNa2SO4,1molNaCl,
由于1molNa2SO4自始至终无法电离,且其溶液pH=7,暂时可以忽略,
则电解过程可先看成电解HCl,再电解NaCl,最后电解水,
即2HCl?通电?.?H2↑+Cl2↑,2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,2H2O?通电?.?2H2↑+O2↑,
生成的NaOH为碱性,pH大于7.
A、阴极自始自终是氢离子放电,只析出H2,故A正确;
B、溶液pH不断增大,最后生成的NaOH为碱性,pH大于7,故B错误;
C、电解最后阶段为电解水,故C正确;
D、阳极氯离子先于氢氧根离子放电,先析出Cl2,后析出O2,故D正确.
故选ACD.
本题解析:
本题难度:一般
2、选择题 按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示

[? ]
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③
B.③④
C.①②④
D.①②⑤
参考答案:D
本题解析:
本题难度:一般
3、填空题 甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
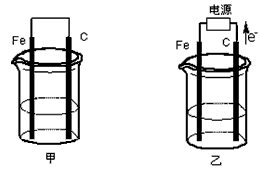
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的___________ 棒;乙池中的____________ 棒。
②在乙池中阳极的电极反应式是_____________ 。
(2)若两池中均盛放饱和NaCl溶液。
①写出甲池中正极的电极反应式____________________ 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的
Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为___________________ 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则此时溶液的pH= ______________。(不考虑电解产物的相互反应)
参考答案:(1)① 碳(C );铁(Fe)
② 4 OH--4 e-== 2H2O + O2↑
(2)①2 Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
②5Cl2 + I2 + 6H2O === 10HCl + 2HIO3
③13
本题解析:
本题难度:一般
4、填空题 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为_____________________________.某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:

(2)在一定体积的18?mol/L的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9?mol,则该硫酸的实际体积________(填“>”“=”或“<”)100?mL. 有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?________(填“可行”或“不可行”).
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?________(填“同意”或“不同意”),原因是______________________________________.另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,简述实验方案、实验现象及由此得出的结论:__________________________________________________________________________.
参考答案:(1)Cu+H2O2+2HCl===CuCl2+2H2O
作图:以铜为阳极,以盐酸为电解质溶液的电解池装置

(2)>;可行
(3)不同意;等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,溶液中Cu2+将一定量的NO2通入铜片与稀硝酸反应后的溶液中,若溶液呈绿色,则该同学的结论正确,反之,不正确(其他合理答案也对)
本题解析:
本题难度:一般
5、实验题 (14分 每空2分)化工原料红矾钠(重铬酸钠:Na2Cr2O7·2H2O)主要是以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下:
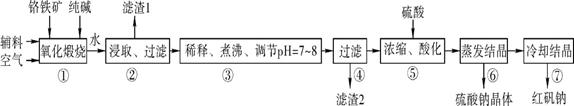
步骤①中主要反应的化学方程式如下:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1) ①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是 。
(2) 杂质Al2O3在①中转化的化学反应方程式为 。
(3) 用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4) ⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式: 。
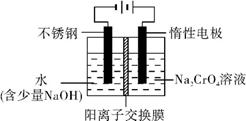
(5) 工业上还可用电解法制备重铬酸钠,其装置示意图如上。
阴极的电极反应式为 ;
阳极的电极反应式为 。
参考答案:(14分 每空2分) (1) 增大反应物的接触面积,加快反应速率
(2) Al2O3+Na2CO3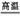 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(3) 水解吸热,煮沸促进水解平衡AlO2-+2H2O Al(OH)3+OH-、SiO32-+2H2O
Al(OH)3+OH-、SiO32-+2H2O H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀
H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀
H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离
(4) 2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(5) 4H2O+4e- 4OH-+2H2↑(H+放电也可)
4OH-+2H2↑(H+放电也可)
4OH--4e- O2↑+2H2O
O2↑+2H2O
本题解析:(1) 固体反应物在搅拌时,可以与氧气充分接触,增大接触面积,使反应速率加快;
(2)氧化铝与碳酸钠在高温条件下发生反应,生成偏铝酸钠和二氧化碳,化学方程式为Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(3)氧化煅烧再溶于水,所得溶液中有偏铝酸钠、硅酸钠、铬酸钠,其中AlO2-、SiO32-水解,水解吸热,煮沸促进水解平衡AlO2-+2H2O Al(OH)3+OH-、SiO32-+2H2O
Al(OH)3+OH-、SiO32-+2H2O H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀;若溶液pH过低,则生成的氢氧化铝沉淀又溶解生成Al3+,杂质Al3+与Na2CrO4难以分离;
H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀;若溶液pH过低,则生成的氢氧化铝沉淀又溶解生成Al3+,杂质Al3+与Na2CrO4难以分离;
(4)酸性条件下CrO42-转化为Cr2O72-,该反应是可逆反应,离子方程式为2CrO42-+2H+ Cr2O72-+H2O;
Cr2O72-+H2O;
(5)电解池中阴极是阳离子放电,根据离子的放电顺序,应是氢离子放电,所以电极反应式为4H2O+4e- 4OH-+2H2↑;或2H++2e-= H2↑;阳极是阴离子放电,所以是氢氧根离子放电,电极反应式为4OH--4e-
4OH-+2H2↑;或2H++2e-= H2↑;阳极是阴离子放电,所以是氢氧根离子放电,电极反应式为4OH--4e- O2↑+2H2O。
O2↑+2H2O。
考点:考查物质制备,涉及反应速率、化学方程式、离子方程式、电极反应式的判断与书写
本题难度:困难