微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.1molNH3催化氧化完全转变为NO时,转移5×6.02×1023e-
B.-140℃下,92g四氧化二氮晶体,恢复到标准状况时,N2O4分子数为6.02×1023个
C.3.9g过氧化钠中含有6.02×1023个O2-离子
D.1mol 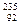 U核素,含有235×6.02×1023个中子
U核素,含有235×6.02×1023个中子
参考答案:A
本题解析:四氧化二氮气体中存在和二氧化氮相互转化的平衡,故92g N2O4气体中的四N2O4分子的物质的量并不是1mol,B错误;过氧化钠中的阴离子并不是O2-而是O22-,C错误;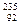 U原子中并没有235个中子,事实上只有143个中子,D错误。
U原子中并没有235个中子,事实上只有143个中子,D错误。
本题难度:一般
2、计算题 将200mL稀硝酸与足量的铜粉在微热的条件下发生反应,经测定,生成了1.12LNO(标准状况)。试计算
(1)参加反应的铜的质量;
(2)该硝酸溶液中HNO3的物质的的量浓度;
参考答案:(1) 4.48 (2)1.0
本题解析:生成的NO是1.12L÷22.4L/mol=0.05mol
所以根据电子的得失守恒可知,消耗铜的质量是
生成硝酸铜的物质的量是0.075mol,则没有被还原的硝酸是0.075mol×2=0.15mol
被还原的硝酸是0.05mol
所以参加反应的硝酸是0.15mol+0.05mol=0.2mol
则硝酸的浓度是0.2mol÷0.2L=1.0mol/L。
点评:该题是基础性试题的考查,难度不大。主要是有利于培养学生的规范答题能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好几种守恒法,即质量守恒定律、原子守恒、电子的得失守恒以及电荷守恒等。
本题难度:一般
3、选择题 摩尔(molar)是
[? ]
A.国际单位制的一个基本物理量
B.表示物质质量的单位
C.计量微观粒子的物质的量的单位
D.表示6.02×1023个粒子的集体
参考答案:C
本题解析:
试题分析:
A.摩尔是国际单位制的一个基本物理量的单位,错误;
B.摩尔是表示物质的量的单位,错误;
C.摩尔是计量微观粒子的物质的量的单位,正确;
D.1摩尔近似是表示6.02×1023个粒子的集合体,错误。
故选:C.
本题难度:简单
4、简答题 现将10mL18mol/L的H2SO4溶液溶于水配置成500mL溶液,求溶液中H+的物质的量浓度.
参考答案:H2SO4的物质的量为0.01L×18mol/L=0.18mol,
则n(H+)=2(H2SO4)=2×0.18mol=0.36mol,
配置成500mL溶液,溶液体积为500mL=0.5L,
故溶液中H+的物质的量浓度为0.36mol0.5L=0.72mol/L,
答:溶液中H+的物质的量浓度为0.72mol/L.
本题解析:
本题难度:一般
5、计算题 (6分)在标准状况下,用一定量的水吸收氨气后得到浓度为12.0mol/L密度为0.915g·cm-3的氨水,试计算(要求写出计算过程):
(1)该氨水溶质的质量分数ω是多少?(用百分数表示,保留到小数点后一位数)
(2)1L水吸收标准状况下的氨气多少升可制得上述氨水?(水的密度以1.00g·cm-3计,计算结果取整数。)
参考答案:(6分)
解:(1)该氨水溶质的质量分数ω为:
ω=C×M/(1000×ρ)=12×17/(1000×0.915)=0.223=22.3% (3分)
(2) 设吸收XL体积的NH3
则c="(X/22.4)/[" (1000+17X/22.4)/(0.915×1000)]=915X/(22400+17X)=12
x=378L (3分)
本题解析:(1)由c=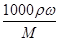 得ω=C×M/(1000×ρ)代入数据得12×17/(1000×0.915)=0.223=22.3%
得ω=C×M/(1000×ρ)代入数据得12×17/(1000×0.915)=0.223=22.3%
(2) 设吸收XL的NH3则NH3的物质的量为X/22.4mol 溶液的质量为17X/22.4+1000g ,溶液的体积为(17X/22.4+1000)g/(0.915g·cm-3×1000)L,可知c="(X/22.4)/[" (1000+17X/22.4)/(0.915×1000)]="12mol/L" ,解得x="378L" 。
考点:物质的量浓度与质量分数的关系
本题难度:困难