微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏伽德罗常数的数值,下列叙述中错误的是(?)
A.标准状况下,22.4LCH4中含有4 NA个共价键
B.在熔融状态下,1molNaHSO4完全电离出的离子总数为3NA
C.5.5g超重水(T2O)中含有的中子数为3 NA
D.7.8gNa2O2与过量CO2反应,转移电子数为0.1NA
参考答案:B
本题解析:标准状况下,22.4L甲烷的物质的量是1mol,含有4mol共价键,A正确;在熔融状态下,硫酸氢钠的电离方程式是NaHSO4=Na++HSO4-,1molNaHSO4完全电离出的离子总数为2NA,B不正确;超重水含有12个中子,则5.5g超重水(T2O)中含有的中子的物质的量是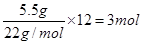 ,C正确;过氧化钠于CO2的反应中既是氧化剂,也是还原剂,转移1个电子,则7.8gNa2O2与过量CO2反应,转移电子数为0.1NA,D正确,答案选B。
,C正确;过氧化钠于CO2的反应中既是氧化剂,也是还原剂,转移1个电子,则7.8gNa2O2与过量CO2反应,转移电子数为0.1NA,D正确,答案选B。
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
2、选择题 等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质和量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是
A.1:2:3
B.3:2:1
C.6:3:2
D.1:1:1
参考答案:C
本题解析:设NaCl、MgCl2、AlCl3三种溶液的物质的量浓度分别是a、b、c。根据反应式Ag++Cl-=AgCl↓可知a=2b=3c,解得a︰b︰c=6:3:2,答案选C。
本题难度:一般
3、简答题 如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
(1)容量瓶应如何检漏:______.
(2)实验中除量筒、烧杯外还需要的其他仪器______.
(3)计算所需浓硫酸的体积约为______mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数______49%(填“<”、“=”或“>”).
(4)配制过程中需先在烧杯中将浓硫酸进行稀释.稀释的操作方法是______.
(5)下列操作会引起所配溶液浓度偏大的是______(填字母).A.用量筒量取浓硫酸时,仰视量筒的刻度B.向容量瓶中转移时,有少量液体溅出C.定容时仰视刻度线D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(6)温度计、量筒、滴定管的一部分如图2所示,下述读数(虚线所指刻度)及说法正确的是______(填字母).A.①是量筒,读数为2.5mLB.②是量筒,读数为2.5mLC.③是滴定管,读数为2.5mLD.①是温度计,读数为2.5℃

参考答案:(1)容量瓶检漏的方法是加适量水后塞紧瓶塞倒置不漏水,然后正放,应注意瓶塞要旋转180度,再倒置看是否漏水,
故答案为:将瓶塞打开,加入少量水,塞好瓶塞,倒转不漏水,然后正放,把瓶塞旋转180度,再倒转不漏水,则说明该容量瓶不漏水;
(2)由于没有480mL的容量瓶,故应使用500mL的容量瓶,根据配制过程可知,还缺少500mL容量瓶、玻璃棒、胶头滴管,
故答案为:500mL容量瓶、玻璃棒、胶头滴管;
(3)由所给浓硫酸标签上的数据易求得该硫酸浓度为:18.4mol?L-1,故配制500mL0.5mol?L-1的稀溶液时约需要13.6mL浓硫酸,
故答案为:13.6;>;
(4)稀释浓硫酸时应将浓硫酸沿器壁慢慢加入到水中,并不断搅拌,操作方法为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌,
故答案为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌;
(5)仰视量筒时,量筒中实际液面高于看到的液面,导致硫酸取多了,结果偏高;B、C两个选项操作均引起结果偏低,
故答案为:A;
(6)A.量筒上没有0刻度值,故A错误;
B.量筒的读数能够读到0.1mL,图②中液体体积为2.5mL,故B正确;
C.滴定管读数时应保留两位小数,正确读数为2.50mL,故C错误;
D.只有温度计的0刻度下还有数据,且图示温度为2.5℃,故D正确;
故答案为:BD.
本题解析:
本题难度:一般
4、选择题 某溶液中只有Na+、Al3+、Cl-、SO42-四种离子.已知Na+、Al3+、Cl-的个数比3∶2∶1,则溶液中Al3+与SO42-的个数比为
A.1∶2
B.1∶4
C.3∶4
D.3∶2