微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)电解前,如果粗盐中SO42ˉ含量较高,必须添加试剂除去SO42ˉ,则按添加试剂顺序,依次发生反应的离子方程式为?。
(2)补齐下列电解饱和食盐水制烧碱的离子方程式:
______________________  __________________________________
__________________________________
(反应物)?(阴极产物)?(阳极产物)
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过?、冷却、??(填写操作名称)除去NaCl。
(4)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水1371 g。经分析,电解后溶液密度为1.37 g·cm-3,其中含有20gNaCl,则电解后NaOH的物质的量浓度为__________mo1·L-1(保留小数点后1位)。
参考答案:(1)Ba2+ + SO42ˉ = BaSO4↓? CO32ˉ+ Ba2+ =BaCO3↓? 2H+ + CO32ˉ= H2O+CO2↑(3分,顺序颠倒没分)
(2)2Clˉ+2H2O  ?H2↑ + 2OHˉ? +? Cl2↑?(2分)
?H2↑ + 2OHˉ? +? Cl2↑?(2分)
阴极产物?阳极产物?
(3)蒸发过滤?(每个1分,共2分)?(4)7.1(2分)
本题解析:(1)除去SO42-需要氯化钡溶液,而过量的氯化钡又需要碳酸钠溶液,最后加入盐酸除去过量的碳酸钠,因此有关反应的方程式是Ba2+ + SO42ˉ = BaSO4↓、CO32ˉ+ Ba2+ =BaCO3↓ 、2H+ + CO32ˉ= H2O+CO2↑。
(2)惰性电极调节食盐水时,阳极是氯离子放电生成氯气。阴极是氢离子放电生成氢气,同时破坏阴极周围水的电离平衡,因此氢氧化钠在阴极生成,所以反应的方程式是2Clˉ+2H2O  ?H2↑ + 2OHˉ? +? Cl2↑?
?H2↑ + 2OHˉ? +? Cl2↑?
阴极产物?阳极产物?
(3)由于氢氧化钠和氯化钠的溶解度随温度的变化相差较大,所以可以通过蒸发、冷却和过滤的方法除去氯化钠。
(4)电解前氯化钠的氯化钠的质量是1371g×37.1/137.1=371g,而电解后氯化钠是20g,所以电解的氯化钠是351g,物质的量是351g÷58.5g/m=6mol。因此根据反应的方程式可知,生成氢氧化钠是6mol,氢气和氯气都是3mol,所以反应后的溶液质量是1371g-2g/mol%3mol-71g/mol×3mol=1152g,则溶液的体积是1152g÷1.37g/ml=840.9ml,所以氢氧化钠的浓度是6mol÷0.841L=7.1mol/L。
本题难度:一般
2、选择题 用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,下列说法正确的是
[? ]
A.阴极反应式为:Cu2++2e-==Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.阴极先是Fe3+放电,后Cu2+放电
D.阴极上不可能析出铜
参考答案:C
本题解析:
本题难度:一般
3、实验题 (17分)I.为探究SO2的性质,需要标准状况下11.2 LSO2气体。化学小组同学依据化学方程式Zn+ 2H2SO4(浓)=ZnSO4+SO2↑+2H2O计算后,取32.5g锌粒与质量分数为98%的浓硫酸(密度 ) 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
) 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是 (用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
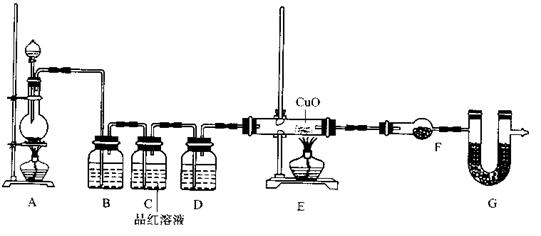
①置B中加入的试剂 ,装置C中品红溶液的作用是 。
②装置D加入的试剂 ,装置F加入的试剂 ; 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G加入的试剂 ,作用为 .
II.工业上可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图所示,回答下列问题:
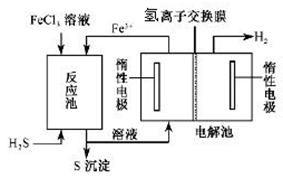
(1)产生反应池中发生反应的化学方程式为 。
(2)反应后的溶液进入电解池,电解时阳极反应式为 。
(3)若电解池中生成5. 6 L H2(标准状况),则理论上在反应池中可生成S沉淀的物质的量为___________ mol。
参考答案:I.(1)H2(1分);随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,
Zn+H2SO4===ZnSO4+H2↑(2分)
(2)①NaOH溶液(或KMnO4,其它合理答案也给分,1分)
证明SO2已被完全除尽。(1分)
②浓硫酸(1分) 无水硫酸铜(1分)
③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色(2分)
④碱石灰(1分)防止空气中H2O进入干燥管而影响杂质气体的检验(1分)
II. (1)H2S + 2FeCl3 = 2FeCl2 + S↓ + 2HCl(2分)
(2)2Fe2+ — 2e- 2Fe3+ (2分)
2Fe3+ (2分)
(3)0.25(2分)
本题解析:I.(1)Zn的物质的量为0.5mol,浓硫酸中含H2SO4为1.84g/mL×60mL×98%÷98g/mol="1.1mol," 随着反应的进行,硫酸浓度降低,当硫酸变为稀硫酸时,发生反应:Zn+H2SO4===ZnSO4+H2↑,所以化学小组所制得的气体中混有的主要杂质气体可能是H2。
(2)①为了防止SO2对H2检验的干扰,装置B中应加入吸收SO2的试剂,NaOH溶液或KMnO4溶液等;装置C中品红溶液的作用是证明SO2已被完全除尽。
②H2还原CuO生成H2O,为了避免原气体中水分的干扰,装置D加入的试剂为浓硫酸;F的作用是检验气体与CuO反应生成了H2O,所以加入的试剂为无水硫酸铜。
③H2还原CuO的实验现象是:装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色。
④为防止外界空气中H2O进入干燥管而影响杂质气体氢气的检验,装置G中应加入碱石灰。
II. (1)根据示意图,反应池加入的FeCl3与H2S为反应物,生成了S,发生了氧化还原反应,所以化学方程式为:H2S + 2FeCl3 = 2FeCl2 + S↓ + 2HCl
(2)反应后的溶液FeCl2和HCl进入溶液,生成H2的电极为阴极,所以阳极上失去电子的离子为Fe2+,所以阳极反应式为:2Fe2+ — 2e- 2Fe3+
2Fe3+
(3)根据电解池中电子守恒和反应池的化学方程式可得关系式:S ~ 2Fe2+ ~ H2,所以n(S)=n(H2)=5.6L÷22.4L/mol=0.25mol。
考点:本题考查实验方案的分析、物质的性质、电解的原理及应用。
本题难度:困难
4、选择题 用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液一定不能与原来溶液一样的是
A.CuCl2(CuCl2)
B.AgNO3(Ag2O)
C.NaCl(NaCl)
D.CuSO4[Cu(OH)2]