微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知A、B、C、D、E为原子序数递增的五种短周期元素,A与C、B与D同主族.E是所在周期原子半径最小的元素,C、D质子数之和是A、B质子数之和的三倍,A元素某种同位素原子不含有中子.请根据以上信息回答:
(1)C2B2的电子式______,A2B2属于______晶体(“分子”、“原子”或“离子”).
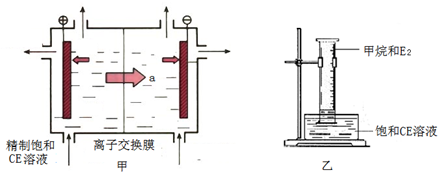
(2)甲装置是离子交换膜法电解饱和CE溶液的原理示意图.透过交换膜的离子a是______,电解的离子方程式______.
(3)为检验E2的性质,某同学做了如下实验:
①Cu丝在E2中燃烧的现象______,你认为Fe丝在E2也可点燃的理由是______.
a.Fe与Cu都是金属元素
b.Fe的熔点比Cu高
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②将乙装置放置在光亮的地方(日光没有直接照射),一段时间后,观察到量筒壁上有油状液滴生成,量筒内气体颜色变浅等.生成的物质有______种,水槽中的液体用饱和CE溶液而不用水的原因是______.
(4)D的单质能跟C的最高价氧化物对应的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式______.
(5)用铂作电极电解1L含有0.4molCuDB4和0.2molCE的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是______.
2、选择题 A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是
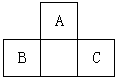
[? ]
A.Be、Na、Al
B.B、Mg、Si
C.O、P、Cl
D.C、Al、P
3、填空题 由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
沉淀物
| Fe(OH)3
| Al(OH)3
| Cu(OH)2
|
沉淀开始时pH
| 2.7
| 4.1
| 8.3
|
沉淀完全时pH
| 3.7
| 5.4
| 9.8
|
?
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
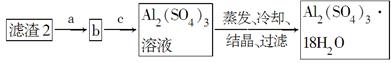
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
4、填空题 在短周元素中,金属性最强的元素是____________,最高价氧化物对应的水化物的酸性最强的元素是
___________,最高价氧化物对应的水化物呈两性的元素是________________,该元素的氧化物对应的水化物与盐酸发生反应的离子方程式为______________________。
5、选择题 下列比较中正确的是
[? ]
A.离子的还原性:S2- >Cl- >Br- >I-
B.氧化性:F2 >Cl2 >S
C.酸性:H2SO4 >HClO4 >H3PO4
D.非金属性:F >Cl >S >O