微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知A、B、C、D、E为原子序数递增的五种短周期元素,A与C、B与D同主族.E是所在周期原子半径最小的元素,C、D质子数之和是A、B质子数之和的三倍,A元素某种同位素原子不含有中子.请根据以上信息回答:
(1)C2B2的电子式______,A2B2属于______晶体(“分子”、“原子”或“离子”).
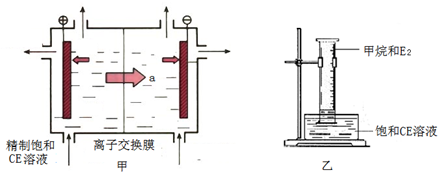
(2)甲装置是离子交换膜法电解饱和CE溶液的原理示意图.透过交换膜的离子a是______,电解的离子方程式______.
(3)为检验E2的性质,某同学做了如下实验:
①Cu丝在E2中燃烧的现象______,你认为Fe丝在E2也可点燃的理由是______.
a.Fe与Cu都是金属元素
b.Fe的熔点比Cu高
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②将乙装置放置在光亮的地方(日光没有直接照射),一段时间后,观察到量筒壁上有油状液滴生成,量筒内气体颜色变浅等.生成的物质有______种,水槽中的液体用饱和CE溶液而不用水的原因是______.
(4)D的单质能跟C的最高价氧化物对应的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式______.
(5)用铂作电极电解1L含有0.4molCuDB4和0.2molCE的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是______.
参考答案:(1)C2B2为过氧化钠,由钠离子与过氧根离子构成,电子数为
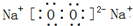
;
A2B2是过氧化氢,属于分子晶体.
故答案为:
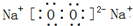
;分子.
(2)CE溶液为氯化钠溶液,左侧连接电源的正极,氯离子放电生成氯气,溶液含有过多的钠离子;右侧连接电源的负极
,氢离子放电生成氢气,溶液中含有过多的氢氧根,为使两侧溶液呈电中性,离子a从左侧透过交换膜到右侧,故离子a是Na+.电解的离子方程式为2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-.
故答案为:Na+;2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-.
(3)①E2是氯气,Cu丝在氯气中燃烧的现象为 产生棕黄色的烟;Cu丝在氯气能燃烧,Fe的金属性比Cu强,Fe丝在氯气中也可点燃燃烧.
故答案为:产生棕黄色的烟;?d.
②E2是氯气,甲烷与氯气在光照条件下发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢5种物质.
水槽中的液体用饱和氯化钠溶液目的是降低Cl2在水中的溶解度,抑制Cl2和水的反应.
故答案为:5;降低Cl2在水中的溶解度,抑制Cl2和水的反应.
(4)D的单质为S,C的最高价氧化物对应的水化物的浓溶液为氢氧化钠溶液,S与氢氧化钠溶液反应生成硫化钠、亚硫酸钠和水,离子方程式为3S+6OH-═2S2-+SO32-+3H2O.
发生氧化还原反应,
(5)CuDB4是硫酸铜,CE是氯化钠,电解含有0.4mol硫酸铜和0.2mol氯化钠的水溶液,阳离子为铜离子放电,阴离子先是氯离子放电生成氯气,氯离子提供的电子的物质的量为0.2mol,由于得到了0.3molCu,转移电子物质的量为0.6mol,所以氢氧根还放电生成氧气,氢氧根提供的电子的物质的量为0.6mol-0.2mol=0.4mol.
? 2Cl--2e-═Cl2↑
0.2mol?0.2mol?0.1mol
4OH--4e-═2H2O+O2↑
?0.4mol?0.1mol
所以生成的气体的体积为(0.1mol+0.1mol)×22.4L/mol=4.48L.
故答案为:4.48L.
本题解析:
本题难度:一般
2、选择题 A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是
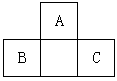
[? ]
A.Be、Na、Al
B.B、Mg、Si
C.O、P、Cl
D.C、Al、P
参考答案:C
本题解析:
本题难度:简单
3、填空题 由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
沉淀物
| Fe(OH)3
| Al(OH)3
| Cu(OH)2
|
沉淀开始时pH
| 2.7
| 4.1
| 8.3
|
沉淀完全时pH
| 3.7
| 5.4
| 9.8
|
?
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
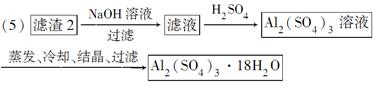
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
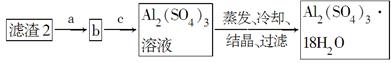
参考答案:(1)烧杯、玻璃棒、漏斗
(2)Al+6H++3NO3—=Al3++3NO2↑+3H2O(或Al+4H++NO3—=Al3++NO↑+2H2O) Au、Pt (3)5.4≤pH<8.3
(4)加热浓缩 冷却结晶
本题解析:(1)进行过滤操作时需要用烧杯盛接滤液,用玻璃棒引流,用漏斗过滤。(2)Cu、Al、Fe、Au、Pt中加入稀硫酸和浓硝酸的混合物并加热时,Cu、Al、Fe都被氧化,硝酸浓度较高时生成NO2,硝酸浓度较低时生成NO,Au、Pt不反应,所以滤渣1为Au、Pt。(3)滤液1中含有Cu2+、Al3+、Fe3+,加入NaOH溶液调溶液pH的目的是实现Cu2+与Al3+、Fe3+的分离,当pH=5.4时,Cu2+没有沉淀,而Al3+、Fe3+沉淀完全,当pH=8.3时,Cu2+开始沉淀,所以调节溶液pH的范围为5.4≤pH<8.3。
(4)可采用加热浓缩、冷却结晶的方法将CuSO4溶液变为CuSO4·5H2O晶体。(5)滤渣2为Fe(OH)3、Al(OH)3的混合物,根据二者的性质差异将二者分离,首先向滤渣2中加入足量NaOH溶液使Al(OH)3溶解得到AlO2—,过滤除去Fe(OH)3,然后向含有AlO2—的溶液中加入适量硫酸使AlO2—转化为Al2(SO4)3,然后蒸发、冷却、结晶、过滤即可得到Al2(SO4)3·18H2O。
本题难度:困难
4、填空题 在短周元素中,金属性最强的元素是____________,最高价氧化物对应的水化物的酸性最强的元素是
___________,最高价氧化物对应的水化物呈两性的元素是________________,该元素的氧化物对应的水化物与盐酸发生反应的离子方程式为______________________。
参考答案:Na;Cl;Al;Al(OH)3+3H+==Al3++3H2O
本题解析:
本题难度:一般
5、选择题 下列比较中正确的是
[? ]
A.离子的还原性:S2- >Cl- >Br- >I-
B.氧化性:F2 >Cl2 >S
C.酸性:H2SO4 >HClO4 >H3PO4
D.非金属性:F >Cl >S >O
参考答案:B
本题解析:
本题难度:一般