微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0. 01mol/L的NaOH加水稀释10倍后溶液的pH值是
A.0.001
B.3
C.11
D.13
参考答案:C
本题解析:0. 01mol/L的NaOH溶液,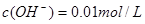 ,即POH=2,则PH=14—2=12;加水稀释10倍后溶液中的
,即POH=2,则PH=14—2=12;加水稀释10倍后溶液中的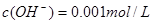 ,即POH=3,则PH=14—3=11;
,即POH=3,则PH=14—3=11;
本题难度:困难
2、选择题 A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
A.原子半径:C>A
B.气态氢化物的稳定性:A>B
C.最高价氧化物对应水化物的碱性:C < D
D.D元素形成的氧化物和氢氧化物能溶于酸,但不能溶于C元素形成的氢氧化物
参考答案:A
本题解析:根据元素的结构及有关性质可知,A、B、C、D四种元素分别是C、O、Na、Al。同周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,A正确;非金属性越强,氢化物的稳定性越强,B不正确,应该是B>A;金属性越强,最高价氧化物的水化物的碱性越强,C不正确,应该是C>D;氧化铝和氢氧化铝都是两性化合物,能溶于氢氧化钠溶液中,D不正确,答案选A。
本题难度:一般
3、选择题 以下说法哪些是正确
A.氢键是化学键
B.甲烷可与水形成氢键
C.乙醇分子跟水分子之间存在着氢键
D.碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键
参考答案:C
本题解析:考查了氢键的概念及存在。氢键仍属于分子间作用力,不属于化学键,它普遍存在于电负性很大的N、O、F原子与氢原子之间,不但可以存在于分子间也可以存在于分子内。故C正确;由于碘化氢的分子量大于氯化氢,使其分子间力相对较大,使其沸点也相对较高。
本题难度:一般
4、选择题 X、Y、Z均为元素周期表中的前20号元素,且可形成化合物XYZ4;三种元素原子序数之和为44,且均不在同一周期,但Y和Z同主族,下列有关推断中正确的是
A.XYZ4是一种微溶于水的盐,且X与Y可形成离子化合物XY
B.XYZ4是一种可溶于水的盐,且X与Y可形成离子化合物XY
C.XYZ4是一种易溶于水的盐,且Y与Z可形成共价化合物YZ
D.XYZ4是一种离子化合物,且Y与Z可形成离子化合物YZ2
参考答案:A
本题解析:根据XYZ4的化学式看,该物质是含氧酸或者含氧酸盐,应考虑Z元素为氧元素,而Y和Z同主族,所以Y元素为硫元素,所以XYZ4中的酸根为SO42-,并且三元素序数和为44,所以X元素为20号元素钙,最终确定该物质为CaSO4,确为一微溶于水的盐类,且硫元素和钙元素也确能形成离子化合物CaS,所以选项A正确。
本题难度:困难
5、选择题 38.4g铜与适量浓HNO3反应,铜全部作用后共收集到22.4L标准状况下气体(不考虑NO2转化为N2O4),则反应消耗HNO3的物质的量为
A.1mol
B.1.6mol
C.2.2mol
D.2.4mol
参考答案:C
本题解析:38.4g铜的物质的量=0.6mol,利用“铜”守恒,得:n[Cu(NO3)2]=0.6mol;
22.4L标准状况下气体的物质的量=1mol,成分为NO、NO2;再利用“N”守恒,得:n(HNO3)=0.6mol×2+1mol=2.2mol,故选C
本题难度:简单