微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+? C.Al3+? D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的名称是________。
②写出在空气中煅烧FeCO3的化学方程式?;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_____________________________________________。
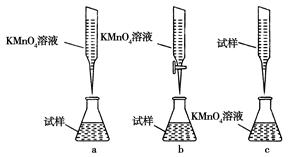
②某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)
③计算上述样品中FeSO4·7H2O的质量分数为?。
参考答案:(14分)(1)Fe2+、Fe3+、H+ (2)B、C
(3)①过滤(1分) 洗涤(1分) ②4FeCO3+O2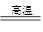 2Fe2O3+4CO2
2Fe2O3+4CO2
(4)①250 mL容量瓶 ②b ③0.975(其余均为2分)
本题解析:(1)磁性的固体Y应该是四氧化三铁,所以与足量盐酸反应后,溶液中的阳离子分别是Fe2+、Fe3+、H+。
(2)氢氧化钠是过量的,因此得不到氢氧化铝沉淀。又因为氢氧化亚铁极易被氧化生成氢氧化铁,所以滤渣应该是氢氧化铁、氢氧化镁和氢氧化铜。滤渣灼烧后生成氧化铁、氧化镁和氧化铜,与足量盐酸反应生成氯化铁、氯化镁和氯化铜,因此所得溶液与原溶液相比,溶液中大量减少的阳离子是Fe2+、Al3+,即答案选BC。
(3)①滤渣从溶液中分离出的方法是过滤,即操作I的名称是过滤。碳酸亚铁沉淀在烘干、煅烧之前必须进行洗涤,所以操作Ⅱ的名称是洗涤。
②由于亚铁离子极易被氧化,所以在空气中煅烧碳酸亚铁的的化学方程式是4FeCO3+O2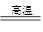 2Fe2O3+4CO2。
2Fe2O3+4CO2。
(4)①由于是配制250ml溶液,所以还需要250 mL容量瓶。
②样品的水溶液是显酸性的,应该用酸式滴定管。同样高锰酸钾溶液具有强氧化性,也应该用酸式滴定管,所以答案选b。
③根据5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O可知,25ml溶液中含有的亚铁离子的物质的量是0.01000mol/L×0.02L×5=0.001mol,则FeSO4·7H2O的质量0.001mol×278g/mol×10=2.78g,所以样品中FeSO4·7H2O的质量分数为2.78g÷2.850g=0.975,即97.5%。
本题难度:一般
2、选择题 向盛有a g镁铝合金的烧杯中加入cl mol/L稀硫酸V1L,合金完全溶解后,再加入c2mol/L的NaOH溶液V2L,生成沉淀的质量恰好达到最大值bg。则下列关系式不正确的是(?)
A.2c1V1=c2V2
B.反应产生氢气的质量m(H2)= 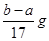
C.b≤a+17c2V2
D.合金中含镁的质量分数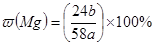
参考答案:D
本题解析:
分析:A、加入氢氧化钠溶液后,沉淀达到最大值,说明镁离子和铝离子都生成了沉淀,溶液中的溶质为硫酸钠,所以2n(Na+)=n(SO42-),2c1V1=c2V2,
B、根据镁、铝与硫酸后再与氢氧化钠的化学方程式,可得到关系式:2Al~3H2~2Al(OH)3,Mg~H2~Mg(OH)2,n(H2)= 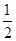 n(OH-),产生氢气的质量=
n(OH-),产生氢气的质量= 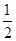 ×
× 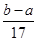 ×2=
×2= 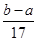 g;
g;
C、沉淀质量=合金质量+合金离子结合氢氧根离子的质量,当硫酸与合金恰好完全反应时,b=a+17c2V2,当硫酸有剩余时,b<a+17c2V2;
D、假设镁的质量为xg,则铝的质量为(a-x)g,由关系式2Al~2Al(OH)3,Mg~Mg(OH)2,求出x,进而求出镁的质量分数.
解:镁铝合金中加入硫酸、再加入氢氧化钠溶液,发生化学反应:2Al+3H2SO4═Al2(SO4)3+H2↑,Mg+H2SO4═MgSO4+H2↑,Al2(SO4)3+3NaOH═2Al(OH)3+Na2SO4,若硫酸过量,加入氢氧化钠后,首先发生反应,H2SO4+2NaOH═Na2SO4+H2O.
A、加入氢氧化钠溶液后,沉淀达到最大值,说明镁离子和铝离子都生成了沉淀,溶液中的溶质为硫酸钠,所以2n(Na+)=n(SO42-),根据原子守恒n(Na+)=n(NaOH)=c2V2,
n(SO42-)=n(H2SO4)=c1V1,所以2c1V1=c2V2,故A正确.
B、根据镁、铝与硫酸后再与氢氧化钠的化学方程式,可得到关系式:2Al~3H2~2Al(OH)3,Mg~H2~Mg(OH)2,
n(H2)=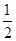 n(OH-),n(OH-)=
n(OH-),n(OH-)=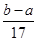 mol,产生氢气的质量=
mol,产生氢气的质量=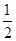 ×
×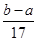 ×2=
×2=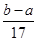 g;故B正确;
g;故B正确;
C、因为沉淀质量=合金质量+合金离子结合氢氧根离子的质量,当硫酸与合金恰好完全反应时,氢氧化钠完全与铝离子和镁离子反应,合金离子结合氢氧根离子的质量=17c2V2g,当硫酸有剩余时,合金离子结合氢氧根离子的质量<17c2V2;所以b≤a+17c2V2;故C正确.
D、假设镁的质量为xg,则铝的质量为(a-x)g,
由关系式Al~Al(OH)3,Mg~Mg(OH)2,
27 78 24 58
a-x x
可知氢氧化铝的质量=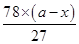 g
g
氢氧化镁的质量= g,
g,
有沉淀总质量为bg,所以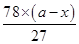 +
+ =b,解之得:x=
=b,解之得:x=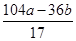 g
g
所以合金中镁的质量分数=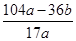 ×100%,故D错误.
×100%,故D错误.
故选D.
本题难度:一般
3、填空题 等质量的铜、铁、锌三种金属混合物Ag投入FeCl3与盐酸的混合溶液中,充分反应后:
(1)若无剩余固体,则溶液中的阳离子一定有?、可能有?。
(2)若剩余固体质量 g,则溶液中的阳离子一定有?、可能有?、一定没有?。
g,则溶液中的阳离子一定有?、可能有?、一定没有?。
(3)若剩余固体质量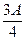 g,则溶液中的阳离子一定有?、一定没有?。?
g,则溶液中的阳离子一定有?、一定没有?。?
参考答案:(1)Zn2+ Fe2+ Cu2+ H+, Fe3+。(2)? Zn2+ Fe2+,H+,Fe3+ Cu2+。(3)Zn2+?, Fe3+ Cu2+ H+。
本题解析:略
本题难度:简单
4、选择题 将过氧化钠投入FeCl2溶液中,可观察到的实验现象是(?)
A.有可燃性气体产生
B.没有沉淀生成
C.有红褐色沉淀生成
D.有白色沉淀生成
参考答案:C
本题解析:略
本题难度:简单
5、实验题 (8分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用在空气中向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到整个过程的实验现象是______________,②加入NaOH溶液后,反应过程中发生反应的化学方程式是______________________和__________________。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有Fe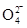 )。
)。
Ⅱ.SCN-的电子式为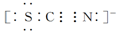
Ⅲ.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为Fe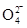 ,请写出该离子反应方程式________________________。
,请写出该离子反应方程式________________________。
②第二种假设是:__________________________。
参考答案:(8分)(1)①产生白色沉淀,迅速变为灰绿色,最终变成红褐色
②FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)①2Fe3++3Cl2+8H2O===2Fe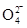 +6Cl-+16H+
+6Cl-+16H+
②SCN-被Cl2氧化 (方程式2分,其余每空1分)
本题解析:(1)由于生成的氢氧化亚铁极易被空气氧化生成氢氧化铁,所以实验现象是首先产生白色沉淀,然后迅速变为灰绿色,最终变成红褐色。有关反应的方程式是FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(2)①在反应铁元素的化合价从+3价升高到+6价,失去3个电子,而氯气只能得到2个电子,所以根据电子的得失守恒可知,反应的方程式是2Fe3++3Cl2+8H2O===2Fe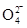 +6Cl-+16H+。
+6Cl-+16H+。
②根据SCN-的电子式可知,S和N元素的化合价分别是-2价和-3价,易被氯气氧化,因此红色也可以褪去。
本题难度:一般