微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:
3Fe2+ + 2S2O32- + O2 + aOH-="=" Y+ S4O62- + 2H2O,下列说法中不正确的是?
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol
D.S2O32-是还原剂
参考答案:C
本题解析:根据氢原子守恒可知,a=4,A正确;在反应中S元素的化合价从+2价升高到+2.5价,2molS2O32-失去2mol电子,作还原剂;1mol氧气得到4mol电子,所以根据电子的得失守恒和原子守恒可知,Fe2+的氧化产物是Fe(OH)3,氢氧化铁能形成胶体,因此选项C是错误的,答案选C。
本题难度:一般
2、选择题 有关化学用 语正确的是
语正确的是
s
A.对甲乙苯的结构简式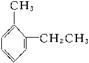
B.丙烷分子的比例模型示意图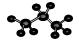
C.乙烯的最简式CH2
D.乙醇的结构简式C2H6O
参考答案:C
本题解析:略
本题难度:一般
3、选择题 下列说法正确的是
A.2mol 溶液与lmol
溶液与lmol 溶液混合后,
溶液混合后, 2mol
2mol
B.120gNaC1溶液中溶有20gNaCl,该温度下NaC1的溶解度为20g
C.22.4LHCl气体溶于水制成1L溶液,该溶液的物质的量浓度为lmol
D.把5g胆矾(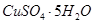 )溶于45g水中,所得溶液溶质的质量分数为10%
)溶于45g水中,所得溶液溶质的质量分数为10%
参考答案:A
本题解析:A、2mol?L?1 KCl溶液Cl?浓度为2mol?L?1,1mol?L?1K2SO4溶液Cl?浓度也为2mol?L?1,所以2mol?L?1 KCl溶液与1mol?L?1K2SO4溶液混合后,c(K+)为2mol?L?1,正确;B、120gNaC1溶液中溶有20gNaCl,该溶液不一定是饱和溶液,错误;C、没有指明为标准状况,22.4LHCl的物质的量不确定,错误;D、CuSO4的质量小于5g,溶液的质量为50g,所得溶液溶质的质量分数小于10%,错误。
本题难度:一般
4、选择题 下列做法中没有用到物质氧化性的是
A.臭氧消毒餐具
B.氯水的漂白
C.二氧化硫的漂白
D.浓硫酸使铁铝表面钝化
参考答案:C
本题解析:分析:生活中常常利用物质的强氧化性进行杀菌消毒,利用浓硝酸和浓硫酸的强氧化性用铁或铝容器进行运输.
解答:A.臭氧是一种强氧化剂,可以把病毒,细菌等氧化而杀死,故A不选;
B.氯水中的次氯酸有强氧化性,能使有色物质褪色,故B不选;
C.二氧化硫和有色物质反应生成无色物质,所以不体现氧化性,故C选;
D.浓硫酸有强氧化性,常温下,能和铝反应生成一层致密的氧化物薄膜而阻止进一步反应,发生钝化现象,故D不选;
故选C.
点评:本题考查氧化还原反应,注意二氧化硫能漂白品红试液但不能漂白酸碱指示剂,为易错点.
本题难度:困难
5、选择题 下列反应一定不属于氧化还原反应的是(?)
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
参考答案:D
本题解析:A、有单质参加的化合反应才属于氧化还原反应,故错;B、有单质生成的分解反应才属于氧化还原反应,故错;D、复分解反应都不属于氧化还原反应,故错。故选C。
点评:本题考查学生氧化还原反应和四大基本反应类型之间的关系知识,可以根据所学知识进行回答,较简单,有化合价变化的反应是氧化还原反应。
本题难度:简单