微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是?。
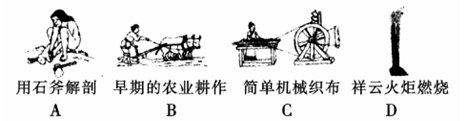
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
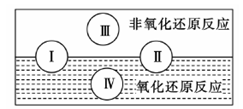
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式:?。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是:

①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是?。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是?(填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
参考答案:(1)D?(2) 2F2 + 2H2O =" 4HF" + O2
(3)①? ?②往容量瓶中加入少量的蒸馏水,盖上瓶塞,看瓶塞处是否漏水,放正,瓶塞旋转180度,重新倒置,看是否漏水?③ABC?④酸式? 0.625mol·L–1
?②往容量瓶中加入少量的蒸馏水,盖上瓶塞,看瓶塞处是否漏水,放正,瓶塞旋转180度,重新倒置,看是否漏水?③ABC?④酸式? 0.625mol·L–1
本题解析:(1)A、B、C都是物理变化,D燃烧是化学反应,且都属于氧化还原反应。(2)四种基本反应类型?中属于氧化还原反应的只有置换反应,水作还原剂,则只能氧元素被氧化,联系氟气与水的反应可写出化学方程式:2F2 + 2H2O =" 4HF" + O2。(3)①反应在酸性溶液中进行,所以方框中应补写H+;Mn的化合价降低5(+7到+2),N元素的化合价升高2(+3到+5),所以MnO4–和Mn2+都配2,NO2–和NO3–都配5,根据电荷守恒,H+配6,根据原子个数守恒H2O配3。②检查容量瓶是否漏水的方法为:往容量瓶中加入少量的蒸馏水,盖上瓶塞,倒置,看瓶塞处是否漏水,正立,瓶塞旋转180度,重新倒置,看是否漏水。③A、少量液体溅出烧杯外,造成溶质的物质的量减小,所配溶液浓度偏小;B、定容时仰视容量瓶上的刻度线,则加水过量,所配溶液浓度偏小;C、“又加入少量水至刻度线”会造成水量增加,溶液浓度偏小。故选ABC。④酸化KMnO4溶液有强氧化性,能氧化橡皮管,所以不用碱式滴定管而用酸式滴定盛装KMnO4溶液;从离子方程式可知KMnO4与NaNO2按2:5的物质的量之比反应,KMnO4的浓度为: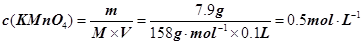 ,则NaNO2溶液的浓度为:
,则NaNO2溶液的浓度为: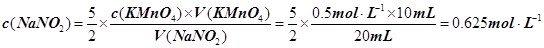 。
。
本题难度:一般
2、选择题 加热下列各物质,发生氧化还原反应的是
A.NH4Cl
B.NH4HCO3
C.浓盐酸
D.浓硝酸
参考答案:D
本题解析:略
本题难度:简单
3、选择题 下列化学用语正确的是
A.CH2CH2 —— 乙烯的结构简式
B.C2H6—— 乙烷的结构式
C. —— 甲烷的电子式
—— 甲烷的电子式
D. —— 苯的分子式
—— 苯的分子式
参考答案:C
本题解析:A 错误,乙烯的结构简式碳碳双键不能省略。
B 错误,乙烷的结构式,形成的共价键都不能省略。
C 正确,甲烷的电子式正确
D 错误,苯的分子式C6H6
本题难度:一般
4、填空题 (1)在标准状况下,相同质量的O2、Cl2、CO2、N2气体中体积最大的是______.
(2)质量均为m?g的三氧化硫和二氧化硫,它们所含的分子个数比为______,硫原子个数比为______,氧原子个数比为______,氧元素的质量比为______.
(3)对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,氧化剂是______,还原剂是______,还原产物是______,氧化产物是______,被氧化与被还原的氯原子个数比为______,若反应消耗了3mol?Cl2则转移电子的物质的量为______.
参考答案:(1)由n=mM=VVm可知,V=m?VmM,则气体的相对分子质量越小,气体的体积越大,相对分子质量最小的是N2,所以体积最大的是N2,故答案为:N2;
(2)n(SO3)=m80mol,n(SO2)=m64mol,由n=NNA可知:
所含的分子个数比等于物质的量之比,N(SO3):n(SO2)=m80:m64=4:5;
由分子组成可知:
硫原子个数比等于分子数之比为4:5;
氧原子个数比为4×3:5×2=6:5;
氧元素的质量比等于个数比为6:5,
故答案为:4:5;4:5;6:5;6:5;
(3)在反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O中,反应前后只有Cl元素的化合价发生变化,则Cl2既是氧化剂又是还原剂,
化合价升高的产物为氧化产物,降低的产物为还原产物,则NaClO3为氧化产物,NaCl为还原产物,反应中Cl元素化合价分别由0价变化为-1价和+5价,
则被氧化与被还原的氯原子个数比为5:1,若反应消耗了3molCl2则转移电子的物质的量为5mol,
故答案为:Cl2;Cl2;NaCl;NaClO3;5:1;5mol.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
A.有单质参加的反应一定是氧化还原反应
B.阳离子只有氧化性,阴离子只有还原性
C.还原剂失电子越多,其还原性越强
D.反应中,某元素由化合态变成游离态时,此元素可能被氧化也可能被还原
参考答案:D
本题解析:略
本题难度:简单