|
高中化学知识点总结《物质的量》试题巩固(2017年最新版)(六)
2017-09-25 19:09:19
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加德罗常数的值,下列说法正确的是
A.NA个氧气分子与NA个氖气分子的质量比是4∶5
B.14g14C和12g12C所含的质子数相等
C.用铝箔包裹0.23gNa,在铝箔上刺些小孔,投入足量水中,放出氢气的体积大于112mL
D.常温常压下,11.2LCO2与8.5gNH3所含分子数相等,均为0.5NA
参考答案:B
本题解析:A不正确,NA个氧气分子与NA个氖气分子的物质的量均为1mol,它们的质量比为:32:20=8:5;
B正确,14C和12C原子互为同位素,14g14C和12g12C所含的物质的量相同均为1mol,所以质子数相等均为6mol;
C不正确,未指明标准状况下体积;D不正确,不是在标准状况下的体积;
本题难度:简单
2、选择题 1 mol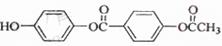 与足量的NaOH溶液充分反应,消耗的NaOH的物质的量为 与足量的NaOH溶液充分反应,消耗的NaOH的物质的量为
A.5 mol
B.4 mol
C.3 mol
D.2 mol
|
参考答案:A
本题解析:根据有机物的结构简式可知,分子中含有的官能团是1个酚羟基和2个酯基。但酯基水解产生的羟基和饱和直接相连,属于酚羟基,所以消耗氢氧化钠是5mol,答案选A。
本题难度:一般
3、计算题 下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
实验次数
| 称取样品的
质量/g
| 所加Ba(OH)2
溶液的体积/L
| 测得生成沉淀
的质量/g
| 1
| 0.518
| 0.5
| 0.985
| 2
| 1.036
| 0.5
| ?
| 3
| 1.554
| 0.5
| 2.955
| 4
| 2.072
| 0.5
| 3.940
| 5
| 2.590
| 0.5
| 3.940
| 6
| 3.108
| 0.5
| 3.940
|
?
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀多少克?请将结果填在表格相应空格中。
(2)样品中KHCO3和Na2CO3的物质的量之比是 。?
(3)室温下,取上述Ba(OH)2溶液50 mL,加入0.05 mol·L-1的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程)。
参考答案:(1)1.970 (2)2∶3
(3)由0.518∶2.072=0.985∶3.940可知第4次实验中反应物恰好完全沉淀,即有:
原0.5 L Ba(OH)2溶液中:n(OH-)="2×(3.940" g÷197 g·mol-1)="0.04" mol,c(OH-)="0.04" mol/0.5 L="0.08" mol·L-1
溶液pH=2,则c(H+)="0.01" mol·L-1
(0.05 mol·L-1×V-0.08 mol·L-1×50 mL)÷(V mL+50 mL)="0.01" mol·L-1
V="112.5" mL
本题解析:(1)分析表中数据可知,第2次实验中Ba(OH)2过量,样品完全反应,则有0.518∶1.036=0.985∶x,x=1.970;(2)第1、2、3次实验均为Ba(OH)2过量,选取第1次计算:
设样品混合物中KHCO3和Na2CO3的物质的量分别为x、y,则有:
100 g·mol-1×x+106 g·mol-1×y="0.518" g
x+y="0.985" g÷197 g·mol-1
解方程组得:x="0.002" mol、y="0.003" mol
故KHCO3和Na2CO3的物质的量之比为2∶3
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值。下列说法正确的是? (?)
A.标准状况下,22.4L乙醇中含有的碳原子数目为2NApfue
B.1mol CnH2n含有的共用电子对数为(3n+1)NA
C.1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA
D.1mol/L的FeCl3溶液中,所含Fe3+的数目小于NA
参考答案:C
本题解析:略
本题难度:简单
5、填空题 甲乙两位同学分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为 。?
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是?
若定容时仰视刻度线,则所配溶液浓度 (填“偏大”、“偏小”或“无影响”)。?
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是 ?。?
③定容的正确操作是 ?。?
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是 (填序号)。?
A.吸出多余液体,使凹液面与刻度线相切
B小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
(3)乙学生:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处: ?。?
参考答案:(1)20.0 mL
(2)①将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地流入容量瓶中 偏小 ②使溶质完全转移到容量瓶中
③加水至离刻度线1~2 cm时,改用胶头滴管滴加水至凹液面与刻度线相切 ④D
(3)不正确;不能用量筒配制溶液,不能将水加入到浓硫酸中
本题解析:(1)根据溶液稀释前后溶质的物质的量不变计算浓硫酸的体积,18 mol/L×V="3.6" mol/L×0.1 L,V="20.0" mL。
(2)①将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地流入容量瓶中;仰视容量瓶刻度线导致加水偏多,溶液的体积偏大,浓度偏小。
④多出的溶液的体积未知,导致溶液的物质的量浓度无法计算,需要重新配制。
(3)量筒不能用于配制溶液,稀释浓H2SO4,应把浓H2SO4加入水中。
本题难度:一般
|