微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的.
(1)工业上用水吸收NO2生产硝酸,生成的尾气经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失).
①试写出上述反应的化学方程式______.
②设循环操作的次数为n次,试写出NO2→HNO3转化率a与循环次数n之间关系的数学关系式.______.
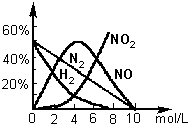
(2)用上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3.实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物.例如镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液液中有Mg(NO3)2、NH4NO3和H2O.生成这些产物的HNO3浓度范围为:H2:c<6.6mol/L;N2和NH4+:c<10.0mol/L;NO:0.10mol/L<c<10.0mol/L;NO2:c>2.0mol/L.各气体产物成分及含量随HNO3的浓度变化曲线如图所示.
①写出Mg与12mol/L的HNO3反应的化学方程式______.
②480mgMg与0.50L4.0mol/L的HNO3充分反应,收集到112mL气体(SPT).试通过计算写出反应化学方程式.______.
参考答案:(1)①NO2与水反应生成HNO3和NO,又NO能被O2氧化为NO2;所以上述反应的化学方程式为3NO2+H2O=2HNO3+NO,2NO+O2=2NO2;
故答案为:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2;
②设起始时NO2物质的量为1 mol,经过nn次循环后生成HNO3的物质的量为:Sn=23+23×13+23×(13)2+23×(13)3+?+23×(13)nn-1,经等比数列求和可得:Sn=1-(13)nn,则NO2生成HNO3转化率为:1-(13)n1=a,即a=1-(13)nn;
故答案为:a=1-(13)nn;
(2)①根据图象可知当硝酸浓度大于10.0mol/L时,气体产物只有NO2,Mg+HNO3→Mg(NO3)2+NO2↑+H2O,反应中HNO3→NO2,N元素从+5价降到+4价得到1个电子,
Mg→Mg(NO3)2,Mg元素从0价升到+2价失去2个电子,所以Mg的计量数为1,NO2的计量数为2,再根据原子守恒配平:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O;
故答案为:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O;
②480mg Mg与0.50L 4.0mol/L的HNO3充分反应,Mg的物质的量比较少为0.02mol,HNO3的物质的量为2mol,反应中硝酸过量,
由图象可知:nn(NO):nn(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,
0.02molMg失去电子为0.04mol,反应生成气体为n=0.005mol,其中nn(NO)=0.005mol×510=0.0025mol,nn(N2)=0.0015mol,n(NO2)=0.0005mol,
n(H2)=0.0005mol,则气体得到电子数为0.0025mol×3+0.0015mol×5×2+0.0005mol×1+0.0005mol×2=0.024mol,
则生成NH4+时N元素得到的电子为0.04mol-0.024mol=0.016,所以生成NH4+的量为0.016×18=0.002mol,
所以n(NO):nn(N2):n(NO2):n(H2):n(NH4+):n(Mg)=5:3:1:1:4:40,
所以NO、N2、NO2、H2、NH4NO3、Mg的计量数分别为5、3、1、1、4、40,再由原子守恒得方程为:40Mg+100HNO3=5NO↑+3N2↑+H2↑+NO2↑+4NH4NO3+40Mg(NO3)2+41H2O;
故答案为:40Mg+100HNO3=5NO↑+3N2↑+H2↑+NO2↑+4NH4NO3+40Mg(NO3)2+41H2O.
本题解析:
本题难度:一般
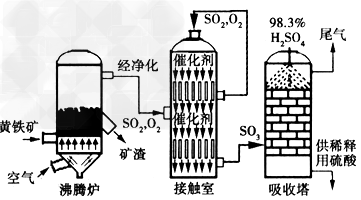
2、填空题 合成氨工业、硫酸工业的生产工艺流程大致为
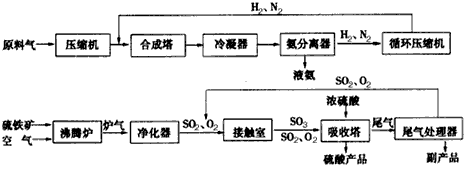
合成塔和接触室中的反应分别为:
N2(g)+3H2(g)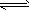 2NH3(g) △H<0 ①
2NH3(g) △H<0 ①
2SO2(g)+O2( g)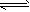 2SO3(g) △H <0 ②
2SO3(g) △H <0 ②
(1)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是____________。
(2)采用循环操作可提高原料的利用率,下列工业生产中,采用循环操作的是_______(填写序号)。
①硫酸工业②合成氨工业③硝酸工业
(3)根据化学平衡移动原理来确定的条件或措施有________(填写序号)。
①合成氨工业在高压下进行
②合成氨工业和硫酸工业都使用催化剂
③合成氨工业和硫酸工业都使用适宜的温度
④硫酸工业中,净化后的炉气中要有过量的空气
⑤及时将氨液化而分离
⑥吸收塔中用98.3%的浓硫酸吸收SO3
⑦硫酸工业的催化氧化在常压下进行
(4)工业生产中常用氨--酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业的尾气中含有
SO2,直接排放到空气中会造成环境污染,引起的后果是_____________,处理该尾气可以得到一种化肥,写出该肥料的化学式________。
参考答案:(1)充分利用反应中放出的热量加热反应气
(2)①②③
(3)①③④⑤
(4)形成酸雨;(NH4)2SO4
本题解析:
本题难度:一般
3、选择题 在硫酸的工业制法中,下列生产操作与说明生产操作的原因都正确的是( )
A.硫铁矿燃烧前要粉碎,是因为大块的硫铁矿不能燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中的杂质要与SO2反应
C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全
D.SO2氧化成SO3时需使用催化剂,这样可以提高SO2的转化率
参考答案:C
本题解析:
本题难度:简单
4、选择题 关于工业制硫酸的说法不正确的是?
[? ]
A.燃烧硫生成SO3
B.SO3与水反应生成H2SO4
C.SO2氧化成SO3需要使用催化剂
D.主要设备是沸腾炉、接触室、吸收塔
参考答案:A
本题解析:
本题难度:简单
5、填空题 [三选一选修2:化学与技术]
以黄铁矿为原料生产硫酸的工艺流程图如下:?
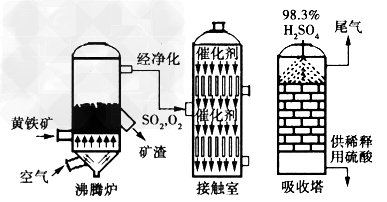
(1)沸腾炉中反应的化学方程式为______,该反应中氧化产物是______,在上述流程图E用线段表示出接触室两个出口出来的与制备反应有关的气体成分及去向。
(2)依据工艺流程图判断下列说法错误的是___________。 ?
a.为使黄铁矿充分燃烧,需将其粉碎?
b.过量空气能提高SO2的转化率 ?
c.使用催化剂能提高SO2的反应速率和转化率 ?
d.从沸腾炉出来的SO2需要净化,其目的是防止催化剂“中毒”
(3)硫酸工业是一种易造成多种形式环境污染的工业,但若处置得当,不仅可防止污染的发生,而且能变废为宝。请你提出一种对尾气进行无害化处理的方案(用方程式表示)________;对矿渣的合理利用方法是_________;对沸腾炉中余热的利用方法是__________________________ .
(4)某工厂用500t含硫48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是______________。 ?
a.705.6t?b.720?t?c.734.7?t?d.750?t
参考答案:(1)4FeS+11O2?2Fe2O3 +8SO2?;Fe2O3、SO2? ;
(2)e?
(3)?SO2+2NH3·H2O=(NH4)2SO3+H2O, (NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O?;炼铁或生产水泥;用于供暖或发电
(4)a
本题解析:
本题难度:一般