微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的.
(1)工业上用水吸收NO2生产硝酸,生成的尾气经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失).
①试写出上述反应的化学方程式______.
②设循环操作的次数为n次,试写出NO2→HNO3转化率a与循环次数n之间关系的数学关系式.______.
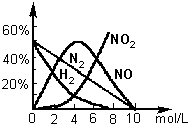
(2)用上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3.实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物.例如镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液液中有Mg(NO3)2、NH4NO3和H2O.生成这些产物的HNO3浓度范围为:H2:c<6.6mol/L;N2和NH4+:c<10.0mol/L;NO:0.10mol/L<c<10.0mol/L;NO2:c>2.0mol/L.各气体产物成分及含量随HNO3的浓度变化曲线如图所示.
①写出Mg与12mol/L的HNO3反应的化学方程式______.
②480mgMg与0.50L4.0mol/L的HNO3充分反应,收集到112mL气体(SPT).试通过计算写出反应化学方程式.______.
参考答案:(1)①NO2与水反应生成HNO3和NO,又NO能被O2氧化为NO2;所以上述反应的化学方程式为3NO2+H2O=2HNO3+NO,2NO+O2=2NO2;
故答案为:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2;
②设起始时NO2物质的量为1 mol,经过nn次循环后生成HNO3的物质的量为:Sn=23+23×13+23×(13)2+23×(13)3+?+23×(13)nn-1,经等比数列求和可得:Sn=1-(13)nn,则NO2生成HNO3转化率为:1-(13)n1=a,即a=1-(13)nn;
故答案为:a=1-(13)nn;
(2)①根据图象可知当硝酸浓度大于10.0mol/L时,气体产物只有NO2,Mg+HNO3→Mg(NO3)2+NO2↑+H2O,反应中HNO3→NO2,N元素从+5价降到+4价得到1个电子,
Mg→Mg(NO3)2,Mg元素从0价升到+2价失去2个电子,所以Mg的计量数为1,NO2的计量数为2,再根据原子守恒配平:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O;
故答案为:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O;
②480mg Mg与0.50L 4.0mol/L的HNO3充分反应,Mg的物质的量比较少为0.02mol,HNO3的物质的量为2mol,反应中硝酸过量,
由图象可知:nn(NO):nn(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,
0.02molMg失去电子为0.04mol,反应生成气体为n=0.005mol,其中nn(NO)=0.005mol×510=0.0025mol,nn(N2)=0.0015mol,n(NO2)=0.0005mol,
n(H2)=0.0005mol,则气体得到电子数为0.0025mol×3+0.0015mol×5×2+0.0005mol×1+0.0005mol×2=0.024mol,
则生成NH4+时N元素得到的电子为0.04mol-0.024mol=0.016,所以生成NH4+的量为0.016×18=0.002mol,
所以n(NO):nn(N2):n(NO2):n(H2):n(NH4+):n(Mg)=5:3:1:1:4:40,
所以NO、N2、NO2、H2、NH4NO3、Mg的计量数分别为5、3、1、1、4、40,再由原子守恒得方程为:40Mg+100HNO3=5NO↑+3N2↑+H2↑+NO2↑+4NH4NO3+40Mg(NO3)2+41H2O;
故答案为:40Mg+100HNO3=5NO↑+3N2↑+H2↑+NO2↑+4NH4NO3+40Mg(NO3)2+41H2O.
本题解析:
本题难度:一般
2、选择题 下列实验设计不能达到预期目的是
A.①
B.②
C.③
D.④
参考答案:A
本题解析:分析:A.硫酸钙微溶,覆盖在碳酸钙的表面,影响实验效果;
B.二氧化氮为红棕色气体,利用颜色的变化来分析温度对平衡的影响;
C.原电池中,Fe为负极,发生Fe与Cu2+的反应;
D.H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液,分解速率不同.
解答:A.因硫酸钙微溶,覆盖在碳酸钙的表面,影响实验效果,不能探究接触面积对反应速率的影响,若改为盐酸能实现实验目的,故A错误;
B.二氧化氮为红棕色气体,利用颜色的变化来分析温度对平衡的影响,则可实现探究温度对化学平衡的影响,故B正确;
C.原电池中,Fe为负极,发生Fe与Cu2+的反应,说明铜离子的氧化性大于亚铁离子的氧化性,故C正确;
D.H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液,分解速率不同,可探究不同催化剂对同一反应速率的影响,故D正确;
故选A.
点评:本题考查实验方案的评价,熟悉影响反应速率的因素、氧化性的比较、化学平衡的影响因素等即可解答,题目难度不大.
本题难度:困难
3、选择题 下列有关物质的性质和该性质的应用均正确的是
A.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体
B.过氧化钠能与二氧化碳反应产生氧气,可用于高空飞行或潜水的供氧剂
C.油脂能在酸性溶液中水解生成高级脂肪酸,可用于防止油脂变质
D.铝的熔点很高,可用于制作耐高温材料
参考答案:B
本题解析:分析:A、浓硫酸和氨气反应不能干燥氨气;
B、过氧化钠和二氧化碳反应生成氧气,做供氧剂;
C、油脂变质是因为高级脂肪酸烃基中的不饱和键;
D、铝是活泼金属.
解答:A、浓硫酸具有吸水性,可用于干燥二氧化碳等气体,和氨气反应不能干燥氨气,故A错误;
B、过氧化钠能与二氧化碳反应产生氧气,人呼出的二氧化碳可以反应转化为氧气,可用于高空飞行或潜水的供氧剂,故B正确;
C、油脂变质是因为高级脂肪酸烃基中的不饱和键,故C错误;
D、氧化铝的熔点很高,可用于制作耐高温材料,铝是活泼金属,不能做耐高温材料,故D错误;
故选B.
点评:本题考查了化学知识的应用,浓硫酸吸水性,过氧化钠的氧化性,油脂结构分析,掌握基础是学习的关键,题目难度中等.
本题难度:一般
4、选择题 下列实验设计能够成功的是
A.A
B.B
C.C
D.D
参考答案:BD
本题解析:分析:A、加入硝酸钡生成的亚硫酸钡沉淀加入硝酸会被氧化为硫酸钡;
B、卤代烃在碱溶液中水解,卤素原子变化为卤离子,加入稀硝酸和硝酸银生成白色沉淀;
C、过氧化氢是氧化剂,稀硝酸是氧化剂,都能氧化碘离子;
D、油污在碱性溶液中水解生成溶于水的物质,用蒸馏水洗涤;
解答:A、加入硝酸钡生成的亚硫酸钡沉淀,加入硝酸会被氧化为硫酸钡,不能证明亚硫酸根离子的存在;故A错误;
B、卤代烃在碱溶液中水解,卤素原子变化为卤离子,加入稀硝酸和硝酸银生成白色沉淀,是氯离子的检验方法;故B正确;
C、过氧化氢是氧化剂,稀硝酸是氧化剂,都能氧化碘离子,碘单质遇淀粉变蓝;故C错误;
D、油污在碱性溶液中水解生成溶于水的物质,铁屑用热的碳酸钠溶液洗涤,油污水解生成溶于水的物质,用蒸馏水洗涤除去;故D正确;
故选BD.
点评:本题考查了离子检验实验设计的方案正误判断,离子性质的分析,注意干扰离子的分析判断,题目难度中等.
本题难度:简单
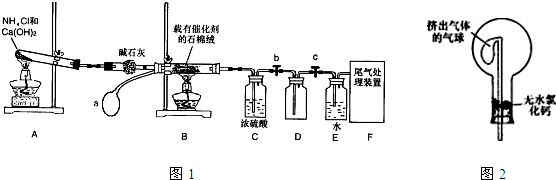
5、简答题 某化学小组模拟工业生产制取HNO3,设计如图1所示装置,其中a为一个可持续鼓入空气的橡皮球.请回答下列问题:
(1)写出装置A中主要反应的化学方程式______.
(2)已知1mol NO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式______.
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是______.
A.降低温度?B.升高温度?C.减小压强?D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是______.
(4)装置C中浓H2SO4的作用是______.
(5)请你帮助该化学小组设计实验室制取NH3的另一方案______.
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图2所示装置(仪器固定装置省略未画)进行验证.实验步骤如下:
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞.
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是______,由此,该同学得出结论:不能用CaCl2代替碱石灰.
参考答案:(1)装置为实验室制氨气的实验装置,目的是制取氨气,所以化学方程式为:2NH4Cl+Ca(OH)2?△?.?2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2?△?.?2NH3↑+CaCl2+2H2O;
(2)1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-136.5kJ?mol-1,两种反应物,需加入一种物质的量来提高另一种物质的转化率,改变温度会改变平衡,对有气体参加的反应,改变压器平衡移动; 采取的措施:因反应是放热反应,所以降低温度平衡右移,二氧化氮转化率提高;反应前后气体体积减少,所以增大压强平衡右移,二氧化氮转化率提高;所以选AD;
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-136.5kJ?mol-1;AD;
(3)制得的二氧化氮气体会转化为四氧化二氮,形成化学平衡 2NO2?N2O4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅;故答案为:颜色变浅;
(4)浓硫酸具有吸水性,可以干燥与之不反应的气体,同时吸收过量的氨气;故答案为:干燥气体,吸收多余的NH3;
(5)利用浓氨水分解制取氨气,故答案为:加热浓氨水制取NH3;
(6)当气球膨胀时,说明烧瓶内的气体压强减小,即氨气被无水氯化钙吸收,故答案为:气球膨胀.
本题解析:
本题难度:一般