微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 ( )

选项
| 试剂
| 现象
| 结?论
|
A
| 酸性KMnO4溶液
| 溶液褪色
| SO2有氧化性
|
B
| 品红溶液
| 溶液褪色
| SO2有漂白性
|
C
| NaOH溶液
| 无明显现象
| SO2与NaOH
溶液不反应
|
D
| 紫色石蕊试液
| 溶液变红色后不褪色
| SO2有酸性,没有漂白性
参考答案:B
本题解析:A.证明SO2有还原性,错误;B.使品红溶液褪色是SO2有漂白性,正确;C. SO2与NaOH溶液发生反应,由于产物容易溶于水,也没有明显的颜色变化等,所以无明显现象,错误;D. SO2使紫色石蕊试液变红色后不褪色,是因为SO2与水反应产生了酸有酸性,但是其只能使某些有色物质褪色,而不是使所有有色物质褪色,错误。2的性质及检验的知识。
本题难度:一般
2、选择题 在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是
A.硫在空气中燃烧
B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应
D.亚硫酸钠与稀硫酸反应
参考答案:A
本题解析:含硫物质被氧化,则硫元素的化合价必然升高,所以答案选A。BC中都是被还原,D不是氧化还原反应。
本题难度:一般
3、选择题 世界年产量95%以上的H2O2由蒽醌氧化法生产。反应过程如下:


下列说法不正确的是(?)
A.H2O2可用作漂白剂、消毒剂,也可作为火箭燃料
B.H2O2可使湿润的KI淀粉试纸变蓝
C.蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2
D.H2O2化学性质稳定,便于储存和运输
参考答案:D
本题解析:H2O2化学性质不稳定,受热后易分解,因此D项错误。H2O2具有强氧化性,A、B项正确;将题目中①②两式合并分析可得知C项正确。
本题难度:简单
4、填空题 某化学兴趣小组的同学为进行物质性质的探究,用维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利滴下
下图所示装置进行实验。请回答下列问题:(加热及固定装置已略去)
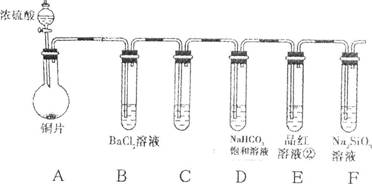
(1)装置A中反应的化学方程式为?
(2)装置C 中的试剂是?( 填序号).
A.氢氧化钠溶液? B. 酸性高锰酸钾溶液? C.亚硫酸氢钠溶液
发生反应的离子方程式为?,其说明了SO2具有?,该实验操作的名称是?。
(3)在上述实验中,能说明碳的非金属性比硅强的实验现象是?
(4)B中的溶液无明显现象,当滴加氯水时有白色沉淀,写出SO2表现还原性并生成白色沉淀的总离子方程式为??
参考答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2)B? 2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,还原性,洗气。(3)E中的品红溶液不褪色,F中有白色沉淀。 (4)Ba2++Cl2+2H2O+SO2= BaSO4↓+4H++2 Cl- CuSO4+SO2↑+2H2O(2)B? 2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,还原性,洗气。(3)E中的品红溶液不褪色,F中有白色沉淀。 (4)Ba2++Cl2+2H2O+SO2= BaSO4↓+4H++2 Cl-
本题解析:(1)反应装置A中为浓硫酸与铜在加热条件下反应,故反应方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O (2)A选项,氢氧化钠与二氧化硫无现象,错误。B选项,正确,二氧化硫具有还原性,能使酸性高锰酸钾溶液褪色,可验证二氧化硫的还原性。C选项,不发生反应。无现象。错误。故选择B选项。离子反应方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+。溶液褪色,证明二氧化硫具有还原性。操作名称为洗气。(3)在D反应器中,二氧化硫与碳酸氢钠溶液发生反应,产生二氧化碳,到达E反应器中,二氧化碳不能使品红褪色,但二氧化碳可以和硅酸钠溶液反应,产生硅酸沉淀,可证明碳酸的酸性强于硅酸,故碳的非金属性强于硅的非金属性。故实验现象为 E中的品红不褪色,F中有白色沉淀生成。(4)B中通入氯气,可将亚硫酸根氧化为硫酸根,产生白色沉淀。故其反应方程式为Ba2++Cl2+2H2O+SO2= BaSO4↓+4H++2 Cl-。 CuSO4+SO2↑+2H2O (2)A选项,氢氧化钠与二氧化硫无现象,错误。B选项,正确,二氧化硫具有还原性,能使酸性高锰酸钾溶液褪色,可验证二氧化硫的还原性。C选项,不发生反应。无现象。错误。故选择B选项。离子反应方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+。溶液褪色,证明二氧化硫具有还原性。操作名称为洗气。(3)在D反应器中,二氧化硫与碳酸氢钠溶液发生反应,产生二氧化碳,到达E反应器中,二氧化碳不能使品红褪色,但二氧化碳可以和硅酸钠溶液反应,产生硅酸沉淀,可证明碳酸的酸性强于硅酸,故碳的非金属性强于硅的非金属性。故实验现象为 E中的品红不褪色,F中有白色沉淀生成。(4)B中通入氯气,可将亚硫酸根氧化为硫酸根,产生白色沉淀。故其反应方程式为Ba2++Cl2+2H2O+SO2= BaSO4↓+4H++2 Cl-。
本题难度:一般
5、填空题 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理?。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是?(填序号)
A.Ba(NO3)2
B.BaCl2
C.Ba(OH)2
D.溶有NH3的BaCl2溶液
|
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为?。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
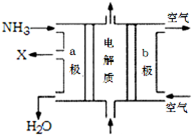
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作?极(填“正”“负”“阴”或“阳”),其电极反应式为?;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为?,请判断T?25℃(填“>”“<”“=”)。
参考答案:(1)①FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+(aq)
②A C D
③c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)。
(2)因为Fe电极在电解过程中产生还原性的Fe2+,将溶液中Cr2O72-还原为Cr3+,Cr2O72-+6Fe2++14H+?=2Cr3++6Fe3++7H2O。若改用石墨电极,阳极产生的是Cl2,不能将Cr2O72-还原为Cr3+。
(3)负? 2NH3+6OH--6e- =N2+6H2O? 2.7×10-13;>
本题解析:(1) FeS尽管难溶,也有一定的溶解度,在溶液中存在着沉淀溶解平衡:FeS(s)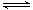 Fe2+(aq)+S2-(aq) ,由于Ksp(FeS)=6.3×10-18mol2·L-2>>Ksp(CuS)=1.3×10-36mol2·L-2,所以当溶液中含有Cu2+时,Cu2+就会与FeS电离产生的S2-结合产生更难溶的沉淀CuS。Cu2++ S2-=CuS↓,FeS再溶解电离,产生的S2-再反应变为CuS沉淀。最终能够把溶液中的Cu2+完全沉淀除去。反应的两种方程式为:①FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+( aq).?② SO2+H2O=H2SO3,溶液显酸性。A.当向其中加入Ba(NO3)2时,也就相当于存在硝酸。硝酸有强氧化性,能把H2SO3氧化产生H2SO4.故会产生BaSO4沉淀。正确。B.假如能与BaCl2发生反应,则反应的方程式为:B.BaCl2+ SO2+H2O=BaSO3↓+2HCl. BaSO3能与HCl发生反应,所以在酸性环境不存在。即该反应是不能发生的。换句话说就是不能发生反应产生沉淀。C.酸性氧化物SO2能与碱发生反应:Ba(OH)2+ SO2=BaSO3↓+ H2O.正确。D.首先发生反应:2NH3+ SO2+H2O= (NH4)2SO3,然后发生:(NH4)2SO3+BaCl2= BaSO3↓+ 2NH4Cl .正确。因此选项为A、C、D。③由于SO2足量。所以反应的方程式为:SO2+NaOH=NaHSO3。NaHSO3=Na++HSO3-。HSO3-在溶液中存在电离平衡HSO3-
Fe2+(aq)+S2-(aq) ,由于Ksp(FeS)=6.3×10-18mol2·L-2>>Ksp(CuS)=1.3×10-36mol2·L-2,所以当溶液中含有Cu2+时,Cu2+就会与FeS电离产生的S2-结合产生更难溶的沉淀CuS。Cu2++ S2-=CuS↓,FeS再溶解电离,产生的S2-再反应变为CuS沉淀。最终能够把溶液中的Cu2+完全沉淀除去。反应的两种方程式为:①FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+( aq).?② SO2+H2O=H2SO3,溶液显酸性。A.当向其中加入Ba(NO3)2时,也就相当于存在硝酸。硝酸有强氧化性,能把H2SO3氧化产生H2SO4.故会产生BaSO4沉淀。正确。B.假如能与BaCl2发生反应,则反应的方程式为:B.BaCl2+ SO2+H2O=BaSO3↓+2HCl. BaSO3能与HCl发生反应,所以在酸性环境不存在。即该反应是不能发生的。换句话说就是不能发生反应产生沉淀。C.酸性氧化物SO2能与碱发生反应:Ba(OH)2+ SO2=BaSO3↓+ H2O.正确。D.首先发生反应:2NH3+ SO2+H2O= (NH4)2SO3,然后发生:(NH4)2SO3+BaCl2= BaSO3↓+ 2NH4Cl .正确。因此选项为A、C、D。③由于SO2足量。所以反应的方程式为:SO2+NaOH=NaHSO3。NaHSO3=Na++HSO3-。HSO3-在溶液中存在电离平衡HSO3-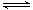 H++SO32-和水解平衡HSO3-+ H2O
H++SO32-和水解平衡HSO3-+ H2O 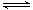 H2SO3+OH-。电离使溶液显酸性,水解使溶液显碱性。因为所得溶液呈酸性,所以电离大于水解。c (H+)>c(OH-).在溶液中除了存在水解平衡外还存在H2O
H2SO3+OH-。电离使溶液显酸性,水解使溶液显碱性。因为所得溶液呈酸性,所以电离大于水解。c (H+)>c(OH-).在溶液中除了存在水解平衡外还存在H2O 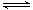 H++OH-,SO32-只有HSO3-电离产生,所以c (H+)>c(SO32-)。电解质的电离程度:HSO3-> H2O。因此c(SO32-)> c(OH-)。无论HSO3-是电离还是水解都要消耗,所以c(Na+)>c(HSO3-).因此溶液中各种离子的浓度关系为:c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)。(2) 用铁电极电解一段时间后, Fe(OH)3沉淀生成,说明Fe与电源的正极相连接,作阳极,被氧化发生还原反应:Fe-2e-=Fe2+.产生的Fe2+有还原性,能将溶液中Cr2O72-还原为Cr3+,二者发生的反应为:Cr2O72-+6Fe2++14H+?=2Cr3++6Fe3++7H2O,Cr3+与Fe3+水解产生Cr(OH)3和Fe(OH)3沉淀,从而可以降低废水中铬元素的含量。若阳极用石墨电极,则电极本身不参加反应,是溶液中的Cl-失去电子。在阳极产生的是Cl2,就不能将Cr2O72-还原为Cr3+。(3)氨设计成碱性燃料电池,产生的X气体可直接排放到大气中。则X为N2,a电极作负极,电极反应为2NH3+6OH--6e- =N2+6H2O。通入空气的电极为正极,发生反应:O2+4e-+2H2O=4OH-。NH3·H2O
H++OH-,SO32-只有HSO3-电离产生,所以c (H+)>c(SO32-)。电解质的电离程度:HSO3-> H2O。因此c(SO32-)> c(OH-)。无论HSO3-是电离还是水解都要消耗,所以c(Na+)>c(HSO3-).因此溶液中各种离子的浓度关系为:c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)。(2) 用铁电极电解一段时间后, Fe(OH)3沉淀生成,说明Fe与电源的正极相连接,作阳极,被氧化发生还原反应:Fe-2e-=Fe2+.产生的Fe2+有还原性,能将溶液中Cr2O72-还原为Cr3+,二者发生的反应为:Cr2O72-+6Fe2++14H+?=2Cr3++6Fe3++7H2O,Cr3+与Fe3+水解产生Cr(OH)3和Fe(OH)3沉淀,从而可以降低废水中铬元素的含量。若阳极用石墨电极,则电极本身不参加反应,是溶液中的Cl-失去电子。在阳极产生的是Cl2,就不能将Cr2O72-还原为Cr3+。(3)氨设计成碱性燃料电池,产生的X气体可直接排放到大气中。则X为N2,a电极作负极,电极反应为2NH3+6OH--6e- =N2+6H2O。通入空气的电极为正极,发生反应:O2+4e-+2H2O=4OH-。NH3·H2O 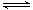 NH4++OH-,
NH4++OH-, 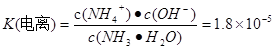 - NH4++ H2O
- NH4++ H2O 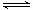 H+ + NH3·H2O,
H+ + NH3·H2O, 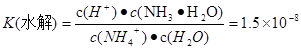 .将两式相乘,可得
.将两式相乘,可得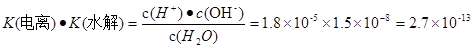 。c (H+)·c(OH-)=K(电离) ·K(水解) ·c(H2O)="Kw." 所以在该温度下水的离子积常数Kw=2.7×10-13.水是弱电解质,升高温度,促进水的电离,水电离产生的离子浓度增大,水的离子积常数也增大。由于2.7×10-13>1.0×10-14.所以温度高于25℃。2的除去方法、含有Cr2O72-的酸性废水的电解法处理、原电池的反应原理及电极式的书写、弱电解质的电离平衡、盐的水解平衡、水的离子积常数的计算的知识。
。c (H+)·c(OH-)=K(电离) ·K(水解) ·c(H2O)="Kw." 所以在该温度下水的离子积常数Kw=2.7×10-13.水是弱电解质,升高温度,促进水的电离,水电离产生的离子浓度增大,水的离子积常数也增大。由于2.7×10-13>1.0×10-14.所以温度高于25℃。2的除去方法、含有Cr2O72-的酸性废水的电解法处理、原电池的反应原理及电极式的书写、弱电解质的电离平衡、盐的水解平衡、水的离子积常数的计算的知识。
本题难度:困难