| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《离子方程式的书写及正误判断》试题特训(2017年最新版)(四)
参考答案: 本题解析: 本题难度:一般 2、填空题 某大型精炼铜厂,在电解铜的阳极泥中含有3-14 参考答案: 本题解析: 本题难度:困难 3、选择题 下列指定反应的离子方程式正确的是 |
参考答案:D
本题解析:A.醋酸是弱酸,应该写化学式,离子方程式是: HCO3-+ 2CH3COOH= CO2↑+ H2O+2CH3COO-,错误;B.CO2气体过量时应该产生: HCO3-,离子方程式是AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-,错误;C.硝酸有强氧化性,会发生氧化还原反应,离子方程式是:3Fe(OH)2 + 10H++NO3- = 3Fe3+ +NO↑+ 8H2O,错误;D.反应符合事实,拆写符合原则,正确。
考点:考查离子方程式书写的正误判断的知识。
本题难度:困难
4、填空题 (12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:
c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中c(H+) c(OH-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O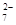 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O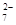 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为 。
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)=" _________" mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
参考答案:(1)Al3+ + 3H2O  Al(OH)3 + 3H+(2分,写“=”和“↓”不得分) (2)MOH
Al(OH)3 + 3H+(2分,写“=”和“↓”不得分) (2)MOH M+ + OH-(2分,写“=”不得分) (3)①< (2分,写“小于”不给分) ②NaHA溶液显碱性,说明HA-水解程度大于电离程度(2分)(4)①Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O(2分) ②2×10-13(2分)
M+ + OH-(2分,写“=”不得分) (3)①< (2分,写“小于”不给分) ②NaHA溶液显碱性,说明HA-水解程度大于电离程度(2分)(4)①Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O(2分) ②2×10-13(2分)
本题解析:(1)生活中明矾常作净水剂,是因为明矾溶于水生成的 Al3+发生水解生成可Al(OH)3胶体能吸附水中的杂质,离子方程式为:Al3+ + 3H2O  Al(OH)3 + 3H+。(2)0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5,说明MOH是弱碱,电离方程式为:MOH
Al(OH)3 + 3H+。(2)0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5,说明MOH是弱碱,电离方程式为:MOH M+ + OH-。(3)c(H2A)>c(A2-)说明HA—的水解程度大于电离程度,HA—水解溶液显碱性,则c(H+)<c(OH-)。(4)①Cr2O72-有强氧化性,Fe2+有还原性,发生氧化还原反应,离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O。②Ksp[Cr(OH) 3]=c(Cr3+)×c3(OH-)=3.0×10-6×c3(OH-)=6.0×10-31,得c3(OH-)=2.0×10-25,Ksp[Fe(OH)3]= c(Fe3+) ×c3(OH-)=4.0×10-38,
M+ + OH-。(3)c(H2A)>c(A2-)说明HA—的水解程度大于电离程度,HA—水解溶液显碱性,则c(H+)<c(OH-)。(4)①Cr2O72-有强氧化性,Fe2+有还原性,发生氧化还原反应,离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O。②Ksp[Cr(OH) 3]=c(Cr3+)×c3(OH-)=3.0×10-6×c3(OH-)=6.0×10-31,得c3(OH-)=2.0×10-25,Ksp[Fe(OH)3]= c(Fe3+) ×c3(OH-)=4.0×10-38,
c(Fe3+) ×2.0×10-25=4.0×10-38,c(Fe3+)=2×10-13mol·L-1
考点:盐类的水解及其应用、溶度积的计算、离子方程式的书写。
本题难度:困难
5、选择题 下列离子方程式的书写正确的是
A.铁与FeCl3溶液反应:Fe +Fe3+="=2" Fe2+
B.小苏打与氢氧化钠溶液混合:HCO3-+ OH-="=" CO2↑ + H2O
C.金属铝加入到NaOH溶液中: Al+2OH-+H2O====AlO2-+2H2↑
D.钠与水的反应 2Na + 2H2O ===2Na+ +2OH- + H2↑
参考答案:D
本题解析:A项电荷没有配平,错;小苏打与氢氧化钠溶液反应不能产生CO2,产物错误,B错;C项电荷没有配平,C错;D对。
考点:离子方程式的判断。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《化学平衡状.. | |