| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《离子方程式的书写及正误判断》试题特训(2017年最新版)(十)
参考答案:C 本题解析:略 本题难度:一般 2、选择题 下列离子方程式书写正确的是 |
参考答案:D
本题解析:A、二者反应至中性时硫酸氢钠物质的量是氢氧化钡物质的量的2倍,与离子方程式不符,错误;B、次氯酸钠具有强氧化性,与亚铁离子发生氧化还原反应,生成氢氧化铁和氯离子,错误;C、亚硫酸氢铵与足量氢氧化钠反应时,亚硫酸氢根离子也与氢氧化钠反应生成亚硫酸根离子和水,错误;D、将1mol/LNaAlO2溶液和1.5mol/L的HC1溶液等体积均匀混合,盐酸稍过量,偏铝酸根离子与氢离子的物质的量符合1:1.5,溶液中既有氢氧化铝沉淀,又有铝离子,符合离子方程式的书写,正确,答案选D。
考点:考查对离子方程式书写的判断
本题难度:一般
3、选择题 11.能正确表示下列反应的离子方程式是
A.铝放入烧碱溶液中溶解:Al+2OH- = AlO2- +H2↑
B.碳酸钙溶于醋酸溶液:CaCO3+2H+ = Ca2++CO2↑+H2O
C.稀硫酸中加氢氧化钡溶液至中性:H+ + OH- = H2O
D.氯化铁溶液呈酸性:Fe3+ + 3H2O 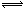 Fe(OH)3 +3H+
Fe(OH)3 +3H+
参考答案:D
本题解析:A项铝放入烧碱溶液中溶解:2Al+2OH- +2H2O= 2AlO2- +3H2↑;B项碳酸钙溶于醋酸溶液,醋酸为弱酸,不能拆成离子,离子方程式为:CaCO3+2CH3COOH= Ca2++CO2↑+H2O+2CH3COO-;C项稀硫酸中加氢氧化钡溶液至中性:2H+ + 2OH-+SO42-+Ba2+ =2H2O +BaSO4↓;D项氯化铁溶液呈酸性:Fe3+ + 3H2O 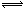 Fe(OH)3 +3H+
Fe(OH)3 +3H+
考点:离子方程式的书写
点评:本题主要考查了离子方程式的书写,但要注意有机反应和无机反应的写法的差别。
本题难度:一般
4、选择题 能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
参考答案:A
本题解析:A.反应符合事实,拆写无误,正确;B.Ca(HCO3)2溶液与少量NaOH溶液反应,应该与NaOH为标准,离子方程式是:Ca2++HCO3-+OH-=CaCO3↓+H2O,错误;C.磁性氧化铁溶于稀硝酸,发生氧化还原反应,产生Fe3+、NO、H2O,反应的离子方程式是:3Fe3O4+NO3-+28H+=9Fe3++NO↑+14H2O,错误;D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,这时Al3+恰好完全反应变为AlO2-,离子方程式是:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O,错误。
考点:考查离子方程式书写的正误判断的知识。
本题难度:一般
5、选择题 下列离子方程式书写正确的是
A.在FeCl3溶液中加入铁粉:Fe3++Fe2Fe2+
B.锌与18.4mol·L--1的H2SO4溶液反应:Zn+2H+Zn2++H2↑
C.用NaOH溶液吸收氯气:C12+2OH-=Cl-+ClO-+H2O
D.稀H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+SO42-+2H+BaSO4↓+2H2O
参考答案:C
本题解析:
正确答案:C
各选项正确的离子方程式A、2Fe3++Fe=3Fe2+ ; B、浓硫酸不写离子方程;D、Ba2++OH-+SO42-+H+ BaSO4↓+H2O
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《化学平衡状.. | |