|
|
|
高考化学必考知识点《化学平衡常数》考点强化练习(2017年押题版)(八)
2017-09-25 19:18:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 两体积相同的密闭容器中均充入1mol?X和1mol?Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g).Z的含量(Z%)随时间t的变化如下图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )
A.曲线a是500℃时的图象
B.正反应是吸热反应
C.t3时刻可能是升高了温度
D.t3时刻可能是减小了压强
| 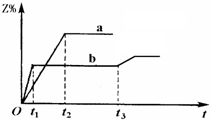
参考答案:A、图象判断,b曲线先到达平衡,反应速率大,说明b曲线的反应温度高,应是500℃时的图象,故A错误;
B、温度升高,Z%的数值减小,说明升高温度平衡向逆向移动,正反应是放热反应,故B错误;
C、t3时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是放热反应,可能为降低温度,不可能是升高温度,故C错误;
D、t3时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是气体体积增大的反应,减小压强,平衡向正反应移动,故可能是减小了压强,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 下列说法中,正确的是
[? ]
A.Kw随温度、浓度的改变而改变
B.凡是能自发进行的化学反应,一定是△H<0、△S>0
C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变
D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
参考答案:D
本题解析:
本题难度:简单
3、填空题 已知:25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HClO)=3.0×10-8,Ka(HF)=
3.5×10-4,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)25℃时,将10 mL pH =1的CH3COOH溶液和10 mL pH =1的HF溶液分别与10 mL 0.1mol/L的NaHCO3溶液混合。
①画出产生的气体体积(V)随时间(t)变化的示意图。
②反应结束后所得的两溶液中,c(CH3COO-)_______c(F-)(填“>”、“<”或“=”)。
(2)25℃时,将少量CO2通入足量NaClO中,写出该反应的离子方程式_________,此反应的平衡常数K=
________________。
(3)0.18 mol/LCH3COONa溶液的pH为____。
参考答案:(1)①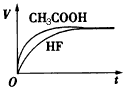 ②> ②>
(2)CO2+H2O+ClO=HCO3-+ HClO;14.3
(3)9
本题解析:
本题难度:一般
4、选择题 已知某可逆反应aA(g)+bB(g)?cC(g)+dD(g).反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的( )
A.正反应为吸热反应
B.降低温度,正反应速率增大
C.a+b<c+d
D.增大压强,B转化率增大
|
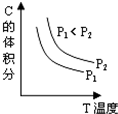
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是

[? ]
A.升高温度能使  增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率 υ(H2)=0.075 mol·L-1·min-1
参考答案:D
本题解析:
本题难度:一般


 CH3OH(g) + H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
 增大
增大