| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《化学平衡》答题技巧(2017年最新版)(八)
 参考答案:B 本题解析: 本题难度:简单 2、选择题 下列叙述中能肯定判断化学平衡发生了移动的是( ) 参考答案:A、对于反应前后气体体积相等的反应来说,增大压强,气体的密度减小,平衡不移动.故A错误; 本题解析: 本题难度:一般 3、选择题 下列实验事实不能用勒沙特列原理解释的是 参考答案:B 本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系,则A、反应2NO2 本题难度:一般 4、填空题 (共12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。 |
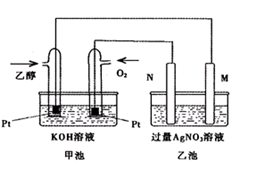
参考答案:(14分)
Ⅰ:(1) 0.225 (2) 75% (3) C
Ⅱ:(1) 铁 (2)C2H5OH-12e+16OH—=2CO32—+11H2O
(3) 1 (4)C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(l) △H=-1366.7kJ/mol
本题解析:Ⅰ.(1)①v(CO2)= 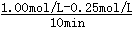 =0.075mol/(L?min),则v(H2)=3×v(CO2)=0.225mol/(L?min),故答案为:0.225;
=0.075mol/(L?min),则v(H2)=3×v(CO2)=0.225mol/(L?min),故答案为:0.225;
(2)由(1)得知,CO2反应了0.75mol,所以CO2的转化率等于0.75mol*100%/1mol=75%;
(3)使n(CH3OH)/n(CO2)增大应使平衡向正反应方向移动:
A.该反应正反应为放热反应,则升高温度平衡向逆反应方向移动,故A错误;
B.充入He气,参加反应的物质的浓度不变,平衡不移动,故B错误;
C.将H2O(g)从体系中分离,生成物浓度减小,平衡向正反应方向移动,故C正确;
D.使用催化剂只能加快反应速率,不能使化学平衡移动,故D错误。
故答案为:C。
Ⅱ.(1)作时M、N两个电极的质量都不减少,M为阴极得到电子,N为阳极是失电子的,综合分析,M极的电极材料为铁。
(2)加入乙醇的电极是负极,失去电子,电极反应式为C2H5OH-12e+16OH—=2CO32—+11H2O。
(3)发生的反应为:
阴极反应:4Ag+ 4e- ==4Ag
阳极反应:4OH- +4e- ==2H2O+O2↑
总反应:4AgNO3 + 2H2O ==4HNO3 + 4Ag+ O2↑
N(Ag)=4.32g/108(g/mol)=0.04mol,n(HNO3)=0.04mol,即n(H+)=0.04mol,c(H+)=0.04mol/0.4L=0.1mol/L,PH=1。
考点:物质的量或浓度随时间的变化曲线 原电池和电解池的工作原理 化学平衡常数的含义 化学平衡的影响因素
点评:本题考查较为综合,涉及反应速率、平衡常数、平衡移动以及电化学等知识,题目难度不大,注意把握影响平衡移动的因素以及平衡移动方向的判断。
本题难度:一般
5、选择题 下列反应既符合图象Ⅰ又符合图像Ⅱ的是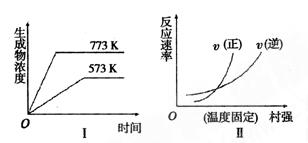
A.N2(g)+3H2(g) 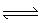 2NH3(g)ΔH<0
2NH3(g)ΔH<0
B.2SO3(g) 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
D.H2(g)+CO(g)  C(s)+H2O(g)ΔH>0
C(s)+H2O(g)ΔH>0
参考答案:D
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《分子式、结.. | |