微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于浓硝酸和浓硫酸的叙述,正确的是
A.常温下都用铜容器贮存
B.露置在空气中,容器内酸液的质量都减轻
C.常温下都能与铜较快反应
D.露置在空气中,容器内酸液的浓度都降低
参考答案:D
本题解析:硝酸在常温下能和铜反应,不能用铜制容器存放,A不正确;浓硫酸具有吸水性,露置在空气中,容器内酸液的质量增加,B不正确;铜和浓硫酸需要在加热的条件下才能完成,C不正确;浓硝酸易挥发、易分解,而浓硫酸具有吸水性,所以露置在空气中,容器内酸液的浓度都降低,D正确,答案选D。
点评:该题是基础性试题的考查,试题注重基础,操作能力的培养和训练。该题的关键是熟练记住浓硫酸和浓硝酸的性质,并能结合题意具体问题、具体分析即可,有利于培养学生的应试能力和学习效率。
本题难度:简单
2、选择题 科学家预测,氨有望取代氢能,成为重要的新一代绿色能源。下列有关说法不正确的是
A.液氨作为清洁能源的反应原理是4NH3+5O2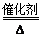 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气轻,标准状况下密度约为0.76 g·L-1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
参考答案:A
本题解析:A、液氨作为清洁能源的反应原理是液氨在纯氧中完全燃烧生成水和氮气,所以的化学方程式为4NH3+3O2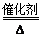 2N2+6H2O,A不正确;B、液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏,B正确;C、氨气的相对分子质量小于空气的,因此氨气比空气轻,标准状况下密度约为17g/mol÷22.4L/mol=0.76 g·L-1,C正确;D、氢气是可燃性气体,燃烧易发生爆炸,因此氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全,D正确,答案选A。
2N2+6H2O,A不正确;B、液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏,B正确;C、氨气的相对分子质量小于空气的,因此氨气比空气轻,标准状况下密度约为17g/mol÷22.4L/mol=0.76 g·L-1,C正确;D、氢气是可燃性气体,燃烧易发生爆炸,因此氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全,D正确,答案选A。
本题难度:一般
3、计算题 3.84 g铜和一定量浓硝酸反应,当铜反应完毕时,共收集到气体的体积为2.24 L(标准状况)。试求:
(1)反应中消耗硝酸的总物质的量。
(2)把收集到气体的集气瓶倒立于盛有水的水槽中,通入多少毫升标准状况下的氧气,可以使集气瓶充满溶液?
参考答案:(1)0.22 mol
(2)672 mL
本题解析:(1)n(HNO3)=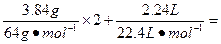 0.12mol+0.1mol=0.22mol。
0.12mol+0.1mol=0.22mol。
(2)由电子守恒得
铜失电子数=被还原硝酸得电子数=还原产物NO、NO2消耗O2得到的电子数,即
Cu失电子数=O2得电子数,
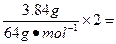 4×n(O2),则n(O2)=0.03 mol,
4×n(O2),则n(O2)=0.03 mol,
V(O2)=0.03 mol×22.4 L·mol-1
=0.672L="672" mL。
本题难度:简单
4、实验题 含氮废水进入水体后而对环境造成的污染越来越严重,对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。
⑴环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式
____________________?。
⑵水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
色阶序号
| 1
| 2
| 3
| 4
| 5
| 6
|
加入溶液B的体积/mL
| 0.0
| 2.0
| 4.0
| 6.0
| 8.0
| 10.0
|
反应后溶液颜色
| 由无色变为由浅到深的樱桃红色
|
?
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点
是?。
②步骤二中设计色阶序号1的作用
是?。
③如果水样显色后比6号还深,应采取的措施
是?。
⑶现有含NH3为3.4mg·L—1的废水150m3(密度为1g·cm-3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3=== NO3- + H+ + H2O? 6NO3-+ 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若用此方法处理,假设每步的转化率为100%,需要甲醇?g。
参考答案:⑴2NO3-+5Mg+6H2O==N2↑+5Mg(OH)2+2OH-
⑵①快速方便易行
②空白对照实验
③将水样先稀释一定倍数后再重复实验
⑶ 800
本题解析:1)完全模仿6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—,用化合价升降法将离子反应方程式配平。(2)的基本原理是将不同浓度的NaNO2加少许氨基苯磺酸制成标准管,然后将采集的水样与各个标准管中颜色做比较从而粗略的测定水样中NO3-的浓度。
(3)6NH3~6 NO3-~5 CH3OH,利用该关系式可算出所需CH3OH的质量。
本题难度:一般
5、填空题 将红热的固体单质甲放入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应。

(1)试推断:甲为__________、乙为__________、丙为__________、A为__________、B为____________、C为____________。
(2)写出甲与乙反应的化学方程式:____________________________________。
参考答案:(1)C?浓HNO3? Cu? CO2和NO2? NO? Cu(NO3)2溶液
(2)C+4HNO3(浓)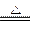 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
本题解析:①遇石灰水产生白色沉淀的气体可能是CO2,故A中可能有CO2气体。
②气体A溶于水生成的溶液与单质丙反应,得到蓝色溶液应为铜盐溶液,可能是单质铜溶于硝酸中,生成蓝色硝酸铜溶液。那么溶于水能生成硝酸溶液的气体应为NO2,所以气体A中可能有NO2。
③将①和②综合考虑,红热的固体单质甲应为木炭,投入显黄色的溶液乙(浓HNO3)中,可以产生混合气体CO2和NO2。
本题难度:简单