微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于浓硝酸和浓硫酸的叙述,正确的是
A.常温下都用铜容器贮存
B.露置在空气中,容器内酸液的质量都减轻
C.常温下都能与铜较快反应
D.露置在空气中,容器内酸液的浓度都降低
2、选择题 科学家预测,氨有望取代氢能,成为重要的新一代绿色能源。下列有关说法不正确的是
A.液氨作为清洁能源的反应原理是4NH3+5O2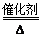 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气轻,标准状况下密度约为0.76 g·L-1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
3、计算题 3.84 g铜和一定量浓硝酸反应,当铜反应完毕时,共收集到气体的体积为2.24 L(标准状况)。试求:
(1)反应中消耗硝酸的总物质的量。
(2)把收集到气体的集气瓶倒立于盛有水的水槽中,通入多少毫升标准状况下的氧气,可以使集气瓶充满溶液?
4、实验题 含氮废水进入水体后而对环境造成的污染越来越严重,对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。
⑴环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式
____________________?。
⑵水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
色阶序号
| 1
| 2
| 3
| 4
| 5
| 6
|
加入溶液B的体积/mL
| 0.0
| 2.0
| 4.0
| 6.0
| 8.0
| 10.0
|
反应后溶液颜色
| 由无色变为由浅到深的樱桃红色
|
?
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点
是?。
②步骤二中设计色阶序号1的作用
是?。
③如果水样显色后比6号还深,应采取的措施
是?。
⑶现有含NH3为3.4mg·L—1的废水150m3(密度为1g·cm-3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3=== NO3- + H+ + H2O? 6NO3-+ 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若用此方法处理,假设每步的转化率为100%,需要甲醇?g。
5、填空题 将红热的固体单质甲放入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应。

(1)试推断:甲为__________、乙为__________、丙为__________、A为__________、B为____________、C为____________。
(2)写出甲与乙反应的化学方程式:____________________________________。