微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)磷有三种同素异形体,分别为白磷(P4)、红磷和黑磷。
(1)白磷常温为白色或淡黄色固体,在40℃左右自燃,实验室保存少量白磷的方法是?。
(2)白磷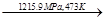 黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是?填选项字母)
黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是?填选项字母)
A.黑磷与白磷互为同分异构体? B.黑磷能导电
C.白磷转化为黑磷为氧化还原反应? D.白磷转化为黑磷为放热反应
(3)红磷在氯气中燃烧生成两种氯化物,其中一种氯化物分子是每个原子最外层都满足8个电子的结构,则该氯化物的空间构型与下列?分子最相似(填选项字母)
A.H2O? B.CCl4?C.NH3?D.CS2
(4)已知白磷、红磷燃烧的热化学方程式分别为
①P4(s、白磷)+5O2(g)=P4O10(s);△H=-986KJ·mol-1
②P(s、红磷)+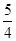 O2(g)=
O2(g)=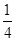 P4O10(s);△H=-739KJ·mol-1
P4O10(s);△H=-739KJ·mol-1
写出红磷转化为白磷的热化学方程式?。
参考答案:

本题解析:白磷易自然,可保存在冷水中,黑磷比白磷稳定.所以白磷转化为黑磷为放热反应(能量越高越不稳定),结构与石墨相似,黑磷能导电,黑磷与白磷互为同素异形体,白磷转化为黑磷不是氧化还原反应;(3)该氯化物为PCl3与NH3相似,为三角锥型;(4)4x②-①得:4P(s,红磷)= P4(s、白磷);?H="+30" KJ·mol-1.
本题难度:一般
2、选择题 13.8g 63%的HNO3溶液密度为1.38g?cm-3和100mL 13.8 mol/L的HNO3溶液相比,正确的是(?)
A.都应用棕色广口瓶存储
B.浓度不同的两种HNO3(aq)
C.溶液的体积不同但浓度相同
D.均可与Au反应而发生钝化现象
参考答案:C
本题解析:略
本题难度:简单
3、简答题
图①-?分别代表有关反应中的一种物质,请填下以下空白。
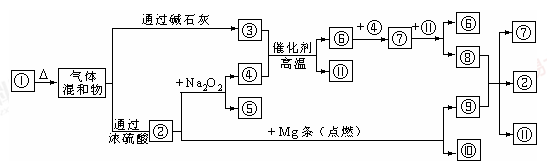
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为?;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是?。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式?。
参考答案:(1)(NH4)2CO3或NH4HCO3? O2
(2)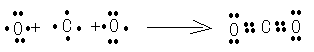
(3)C+4HNO3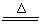 4NO2↑+CO2↑+2H2O,用湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则生成氨气;
4NO2↑+CO2↑+2H2O,用湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则生成氨气;
(4)3Mg+8H++2NO3-=3Mg2++2NO↑+4H2O
本题解析:由②+Mg→⑨+⑩,想到中学化学的典型反应CO2+2Mg=C+2MgO知②为CO2为突破口,由②+Na2O2→④+⑤,且②为CO2,推断知④、⑤为Na2CO3和O2,由③+④ ⑥+
⑥+ ?推断知④为O2则⑤为Na2CO3,③为NH3,其余依次推出,①为(NH4)2CO3或NH4HCO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,⑩为H2O。
?推断知④为O2则⑤为Na2CO3,③为NH3,其余依次推出,①为(NH4)2CO3或NH4HCO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,⑩为H2O。
本题难度:一般
4、选择题 如图是进行气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是
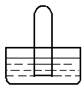
A.若水槽中是水,试管中是Br2蒸气,可看到试管中液面并未有明显上升
B.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管
C.若水槽中是水(并滴有一定量酚酞),试管中是NH3,可看到液面上升并呈红色
D.若水槽中是水,试管中是NO,可看到试管中液面并未有明显上升
参考答案:B
本题解析:A正确,Br2蒸气在水中的溶解很小,试管内的压强未发生明显的变化,所以兴液面未有明显上升;
B错,NO2与水反应的化学方程式为:3NO2+H2O=2HNO3+NO;根据方程式可知试管内液面应上升到试管容积的2/3处;
C正确,氨气极易溶于水,常温常压1L的水约能溶解700体积的氨,导致试管内液面急剧上升,并充满整个试管,又因氨气溶于水后生成了一水合氨,溶液呈碱性,使酚酞试液变红;
D正确,NO气体难溶于水,试管内液面不可能明显上升;
本题难度:一般
5、填空题 (12分)下图表示各物质之间的转化关系。已知:常温下B、D、F、G、I、J是气体, F、G是空气中的主要成分,D是一种碱性气体。A中阴、阳离子个数比是1∶1, E是一种黑色氧化物,H是紫红色金属单质。(部分生成物和反应条件省略)

请按要求填空:
(1)A物质的化学式是?;
(2)反应③的化学方程式是?;
反应④的离子方程式是?;
(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是?;
(4)检验溶液A中阳离子的方法是?
?;
(5)反应②中氧化剂是?;
参考答案:(1)NH4HCO3?
(2)4NH3+5O2  4NO+6H2O ?Cu+4H++2NO3-===Cu2++2 NO2↑+2H2O ?
4NO+6H2O ?Cu+4H++2NO3-===Cu2++2 NO2↑+2H2O ?
(3)6.02×1022?
(4)取少许溶液A于试管,加入NaOH溶液,微热,能产生使湿润的红色石蕊试纸变蓝的气体,则说明有NH4+?。?(5)CuO?(每空2分)
本题解析:常温下B、D、F、G、I、J是气体,F、G是空气中的主要成分,分别为氧气、氮气中的一种,D是一种碱性气体,则D为NH3,E是一种黑色氧化物,H是紫红色金属单质,结合转化关系②可知,E为CuO、H为Cu,G为N2、C为H2O,故F为O2,由F与D得到I、I能与F继续反应生成J,则I为NO、J为NO2,J与C(H2O)反应生成K,K与H(Cu)反应得到二氧化氮,则K为HNO3,固体A分解得到氨气、水与气体B,B能与X反应得到F(氧气),则B为CO2,X为Na2O2;
⑴A中阴、阳离子个数比是1:1,故A为NH4HCO3;
⑵通过由上述分析可知,反应③的化学方程式是4NH3+5O2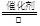 4NO+6H2O;反应④的离子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
4NO+6H2O;反应④的离子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
⑶反应①为2CO2+2Na2O2=2Na2CO3+O2,产生标准状况下1.12L氧气,其物质的量=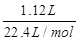 =0.05mol,反应中氧元素由-1价升高为氧气中0价,转移电子的物质的量为0.05mol×2×[0-(-1)]=0.1mol,转移电子数为6.02×1022;
=0.05mol,反应中氧元素由-1价升高为氧气中0价,转移电子的物质的量为0.05mol×2×[0-(-1)]=0.1mol,转移电子数为6.02×1022;
⑷溶液A中阳离子为NH4+,检验NH4+的方法是:取少许溶液A于试管,加入NaOH溶液,微热,能产生使湿润的红色石蕊试纸变蓝的气体,则说明有NH4+;
⑸反应②是氨气与CuO反应生成氮气、Cu与水,反应中CuO转化Cu元素化合价由+2降低为0价,故CuO是氧化剂。
本题难度:一般