| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《化学反应与能量》考点预测(2017年强化版)(四)
参考答案:B 本题解析:略 本题难度:简单 3、选择题 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示。下列叙述中正确的是 |
参考答案:A
本题解析:A.白磷转化为黑磷是放热反应,则黑磷比白磷稳定,白磷的能量高,A正确;B.黑磷与白磷是单质,B错误;C.白磷转化为黑磷中磷的化合价未变,不是氧化还原反应,C错误;D.白磷转化为黑磷是放热反应,D错误,选A。
考点:考查物质的稳定性与能量的关系、同分异构体、氧化还原反应、物质的结构决定物质的性质等知识。
本题难度:一般
4、选择题 下列物质中,既含离子键、又含共价键的是( )
A.NaOH
B.Na2O
C.NH4Cl
D.CaCl2
参考答案:A、NaOH为离子化合物,含有离子键,OH-离子中含有共价键,故A正确;
B、Na2O只含有离子键,故B错误;
C、NH4Cl为离子化合物,含有离子键,NH4+离子中含有共价键,故C正确;
D、CaCl2只含有离子键,故D错误.
故选AC.
本题解析:
本题难度:简单
5、填空题 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为?,含有离子键、?等化学键。
(2)生成物中含有10个电子的分子是?(写分子式),该分子的空间构型为?,中心原子的杂化方式为?。
(3)反应物中电负性最大的元素为?(填元素符号),写出其原子最外层的电子排布图:?。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。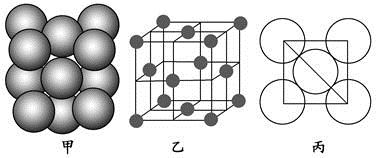
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为?;Al晶体的密度为?(用字母表示)。
参考答案:(1)Na3AlF6 配位键
(2)H2O V形 sp3
(3)F 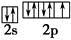
(4)4 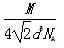
本题解析:(1)冰晶石的化学式为Na3AlF6,Na+与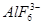 之间为离子键,而
之间为离子键,而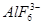 是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为
是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为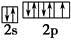 。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6×
。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6×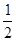 +8×
+8×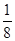 =4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2d,Al晶胞的体积为V=16d3,故Al晶体的密度为
=4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2d,Al晶胞的体积为V=16d3,故Al晶体的密度为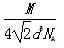 。
。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《气体的净化.. | |