1、选择题 将足量的AgI固体分别放入下列物质中,AgI的溶解度由大到小的排列顺序是( )
①5mL0.001mol?L-1KI溶液?
②15mL0.002mol?L-1CaI2溶液
③35mL0.003mol?L-1HI溶液?
④15mL蒸馏水?
⑤45mL0.005mol?L-1AgNO3溶液.
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
参考答案:AgI在溶液中存在溶解平衡:AgI(s)?Ag+(aq)+I-(aq),由于c(Ag+)或c(I-)对溶解平衡有抑制作用,则溶液中c(Ag+)或c(I-)越大,则AgI的溶解度越小:
①c(I-)=0.001mol/L,②c(I-)=0.004mol/L,③c(I-)=0.003mol/L,④c(I-)=0,⑤c(Ag+)=0.005mol/L,
则c(Ag+)或c(I-)由大到小的顺序为⑤>②>③>①>④,
所以AgI的溶解度由大到小的排列顺序是④>①>③>②>⑤,
故选B.
本题解析:
本题难度:一般
2、选择题 已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。

滴定时,你认为该滴定适宜选用的指示剂是
[? ]
A.KBr
B.KI
C.K2S
D.K2CrO4
参考答案:D
本题解析:
本题难度:一般
3、填空题 工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如下图所示,已知CaSO4的Ksp=9.1×10-6,CaCO3的Ksp=2.8×10-9,请回答:
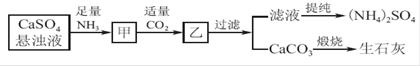
(1)向甲中通入过量CO2_____(填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_______________________________________________________________。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是________(填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松,易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为____________________________________。
②请分析CaSO4转化为CaCO3的原理:__________________________________________。?
参考答案:(1)不(1分) 通入过量的CO2会使CO32-转化为HCO3-(1分),从而CO32-浓度减小,不利于CaSO4转化为CaCO3 (1分)[类似的意思参照 给分]
(2)(1分)(NH4)2CO3或碳酸铵(写碳酸氢铵不给分)
(3)(5分)①(2分)CaSO4(s)+CO32-(aq)  CaCO3(s)+SO42-(aq) 【任错1处0分】
CaCO3(s)+SO42-(aq) 【任错1处0分】
②(3分)CaSO4存在沉淀溶解平衡CaSO4(s)? ?Ca2+(aq)+SO42-(aq)[1分] ,当加入Na2CO3溶液后,CO32-与Ca2+结合生成溶度积更小的CaCO3沉淀(1分),溶液中Ca2+浓度减少,使CaSO4的溶解平衡向溶解的方向移动(1分)
?Ca2+(aq)+SO42-(aq)[1分] ,当加入Na2CO3溶液后,CO32-与Ca2+结合生成溶度积更小的CaCO3沉淀(1分),溶液中Ca2+浓度减少,使CaSO4的溶解平衡向溶解的方向移动(1分)
本题解析:⑵向氨化的CaSO4悬浊液中通入适量CO2,二氧化碳会跟里面的氨全部反应生成碳酸铵。
本题难度:一般
4、填空题 (16分)氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”),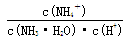 ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时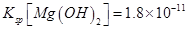 mol3
mol3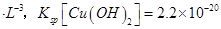 mol3.L-3).
mol3.L-3).
参考答案:Ⅰ. (1)1/2 N2 + 3/2 H2 NH3(2分) (2)正向进行(2分) (3)c(2分)
NH3(2分) (2)正向进行(2分) (3)c(2分)
Ⅱ.(4)增大(1分) 不变 (2分)
(5)NH4++H2O NH3?H2O+H+(2分) 10-5(10-5-10-9)/2a+10-9-10-5 mol·L-1(2分)
NH3?H2O+H+(2分) 10-5(10-5-10-9)/2a+10-9-10-5 mol·L-1(2分)
(6)Cu(OH)2(1分) Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+(2分)
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据平衡常数可知反应的化学方程式为1/2 N2 + 3/2 H2 NH3。
NH3。
(2)在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则产生浓度熵为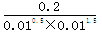 =2000<3000,所以反应向正反应方向进行。
=2000<3000,所以反应向正反应方向进行。
(3)a与b相比,a中含有大量的氨气,因此b中氨气的转化率大于a中。b与d相比,b中氢气浓度大,大转化率高;由于正方应是体积减小的可逆反应,所以增大压强平衡向正反应方向进行,c与b相比,相当于是在b的基础上增大压强,氮气转化率增大,答案选c。
(4)稀释促进氨水的电离,电离程度增大。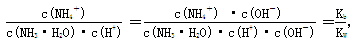 ,因此比值不变。
,因此比值不变。
(5)铵根水解溶液显酸性,方程式为NH4++H2O NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O
NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O NH3?H2O+H+的平衡常数的表达式为
NH3?H2O+H+的平衡常数的表达式为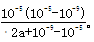 。
。
(6)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+。
考点:考查平衡常数计算与应用、外界条件对电离平衡的影响、盐类水解以及溶度积常数应用等
本题难度:困难
5、选择题 下列叙述中正确的是? ( )
A.溶度积大的化合物溶解度一定大
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解,又达到平衡时,AgCl的溶解度不变,溶度积也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl是弱电解质
参考答案:B
本题解析:对于阴、阳离子个数比不同的电解质来讲,A项叙述是错误的;温度一定时,AgCl的溶解度和溶度积都一定,B正确;Ksp在数值上等于达到溶解平衡时离子浓度幂之积,并不是离子浓度的乘积,AgCl属于强电解质,C、D两项均错。
本题难度:一般