1、填空题 碳和硅属于同主族元素,在生活生产中有着广泛的用途。
(1)甲烷可用作燃料电池,将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,通入CH4的一极,其电极反应式是?;
CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160kJ·mol-1
则NO2被甲烷还原为N2的热化学方程式为_____________________________________
(2)已知H2CO3 HCO3-+ H+? Ka1(H2CO3)=4.45×10-7
HCO3-+ H+? Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+? Ka2(HCO3-)=5.61×10-11
CO32-+H+? Ka2(HCO3-)=5.61×10-11
HA H++A-? Ka(HA)=2.95×10-8
H++A-? Ka(HA)=2.95×10-8
请依据以上电离平衡常数,写出少量CO2通入到NaA溶液中的离子方程式
___________________________。
(3) 在T温度时,将1.0molCO2和3.0molH2充入2L密闭恒容器中,可发生反应的方程式为CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转?化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转?化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英(SiO2)与焦炭在高温的氮气流中反应生成,已知该反应的平衡常数表达式K=[c(CO)]6/[c(N2)]2,若已知CO生成速率为v(CO)=6mol·L-1·min-1,则N2消耗速率为v(N2)=?;该反应的化学方程式为________________________________________。
参考答案:(1) CH4-8e-+ 10OH-=CO32-+ 7H2O
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)?△H=-867kJ·mol-1(3分,方程式1分,数值2分)
(2) CO2+ A-+ H2O = HCO3-+ HA
(3) 400(1-a)%或4(1-a)×100%或(4-4a)×100%(3分,没有表示为百分号形式的不得分)
8/27 L/mol (3分,没有单位或单位错误扣1分)
(4) 2mol·L-1·min-1(3分,没有单位或单位错误扣1分);
3SiO2+6C+ 2N2 Si3N4+ 6CO(没写可逆符号或缺少条件的扣1分)
Si3N4+ 6CO(没写可逆符号或缺少条件的扣1分)
本题解析:(1)甲烷在碱性条件下失电子生成CO32?,配平可得电极方程式:CH4-8e-+ 10OH-=CO32-+ 7H2O;首先写出NO2与CH4反应的化学方程式并注明状态,然后根据盖斯定律求?H,第二个反应对比N2,第一个反应与第二个反应抵消NO,所以?H=1/2?H1+1/2?H2=-867kJ·mol-1,进而写出热化学方程式。
(2)根据题目所给信息可知:Ka1(H2CO3)> Ka(HA) > Ka2(HCO3-),根据强酸制弱酸的原理,少量CO2通入到NaA溶液中的离子方程式为:CO2+ A-+ H2O = HCO3-+ HA
(3)因为压强之比等于气体物质的量之比,设CO2的转化率为x,根据三段式进行计算:
CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g)
CH3OH(g) + 2H2O(g)
起始物质的量(mol)? 1? 3? 0? 0
转化物质的量(mol)? x? 3x? x? 2x
平衡物质的量(mol) 1-x? 3-3x? x? 2x
则(4-x):4=a:1,解得x=4-4a,所以CO2的转化率为:400(1-a)%或4(1-a)×100%或(4-4a)×100%;
a=0.875时,x=0.5,则平衡常数为:0.5mol/L×(1mol?L?1)2÷[0.5mol/L×(1.5mol?L?1)3]="8/27" L/mol。
(4)根据平衡常数表达式K=[c(CO)]6/[c(N2)]2,可得化学方程式中CO的系数为6,N2的系数为2,反应物还有SiO2和C,生成了Si3N4,配平可得化学方程式:3SiO2+6C+ 2N2 Si3N4+ 6CO;v(N2)=1/3 v(CO)=6mol·L-1·min-1×1/3= 2mol·L-1·min-1。
Si3N4+ 6CO;v(N2)=1/3 v(CO)=6mol·L-1·min-1×1/3= 2mol·L-1·min-1。
本题难度:一般
2、选择题 以下变化是熵减小过程的是
A.碳酸氢钠受热分解
B.氨气与氯化氢气体反应
C.C(s,石墨)+H2O(g)=CO(g)+H2(g)
D.液态水气化
参考答案:B
本题解析:熵表示物质的混乱程度,对于同一种物质来讲,气态时熵值最大,固态时最小,所以选项B是熵值减小的反应,其余都是增加的,答案选B。
本题难度:简单
3、选择题 在氢气跟氧气的反应中,破坏1mol氢气中的化学键消耗的能量为A,破坏1mol氧气中的化学键消耗的能量为B,形成1mol水中的化学键释放的能量为C.则下列关系正确的是( )
A.A+B>C
B.A+B<C
C.2A+B<2C
D.2A+B>2C
参考答案:氢气跟氧气的反应的化学方程式为2H2+O2=2H2O,因燃烧反应为放热反应,断开旧的化学键吸收的总能量小于形成新的化学键放出的总能量,即2A+B<2C,故选:C.
本题解析:
本题难度:一般
4、选择题 单斜硫和正交硫转化为二氧化硫的能量变化图如图所示。
下列说法正确的是
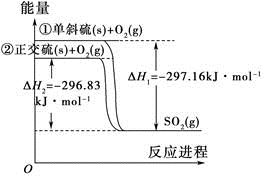
A.S(s,单斜)=S(s,正交) ΔH=+0.33 kJ·mol-1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ
参考答案:B
本题解析:①-②得:S(s,单斜)=S(s,正交) ΔH=-0.33 kJ·mol-1,A项错误;可知单斜硫转化为正交硫时要放出热量,正交硫的能量要低,较稳定,B项正确;相同物质的量的正交硫应该比单斜硫所含有的能量要低,C项错误;①式表示断裂1 mol S和1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ,D项错误。
本题难度:一般
5、选择题 下列有关能量转换的说法正确的是
[? ]
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
参考答案:AB
本题解析:
本题难度:简单