|
|
|
高考化学试题《化学实验的基本操作》试题预测(2017年最新版)(十)
2017-11-05 20:36:08
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、实验题 碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
Ⅰ.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:
 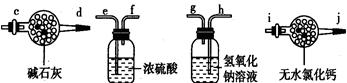
(1)请选择必要地装置,按气流方向连接顺序为?。
(2)分液漏斗中的液体最适合的是?。
A.稀盐酸
B.稀硫酸
C.浓硝酸
D.氢氧化钠
| (3)连在最后的装置起到的作用?。
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(1)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用?(填“酸式”或“碱式”)滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴?指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
滴定次数
| 滴定前读数(mL)
| 滴定后读数(mL)
| 1
| 1.20
| 16.21
| 2
| 3.00
| 18.90
| 3
| 4.50
| 19.49
|
?
达滴定终点时的现象为?,由此可计算出该样品中的氮的质量分数为?。
(2)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值?(填“偏大”“偏小”或“无影响”)。
Ⅲ.如果测定碳酸氢铵中的含氮量时,使用甲醛法是否合理?(填“是”或“否”),理由是?。
参考答案:Ⅰ(1)b-e,f-h,g-c ?(2)B ?(3)防止空气中水和二氧化碳进入装置影响实验结果;
Ⅱ(1)酸式?酚酞?溶液从无色变为浅红色 ,30s内不褪色 ?14%?(2)偏小
Ⅲ否,因为用氢氧化钠标准溶液滴定时,溶液中HCO3—中的H+也会和氢氧化钠中和
本题解析:Ⅰ.(1)本题考查实验装置的选择和连接,实验装置的连接顺序为发生装置、净化装置、干燥装置、性质或收集装置、尾气处理装置。一般除杂在前,干燥在后;若是燃烧管除杂,则干燥在前;若用洗气瓶,则“长进短出”,若用干燥管,则“大进小出”;根据题意知,装有氢氧化钠溶液的洗气瓶为二氧化碳的吸收装置,为保证实验结果准确,必须防止水蒸气和外界空气的干扰;为保证分液漏斗内液体顺利流下,应选第二个装置作为二氧化碳的发生装置;根据上述分析连接次序为:b-e,f-h,g-c;(2)盐酸和硝酸易挥发,会干扰二氧化碳的测定,氢氧化钠溶液与样品反应不会生成二氧化碳,所以分液漏斗内的液体应为稀硫酸,选B;(3)连在最后的装置起到的作用为防止空气中水和二氧化碳进入装置影响实验结果;
Ⅱ(1)(NH4)2SO4属于强酸弱碱盐,水解显酸性,所以用酸式滴定管准确取出20.00mL的溶液;滴定终点的pH约为8.8,酚酞变色范围为8.2——10,应用酚酞作指示剂;用浓度为0.08mol/L氢氧化钠标准溶液滴定,达滴定终点时的现象为溶液从无色变为浅红色 ,且30s内不褪色;分析题给数据知,第二组数据误差较大,应舍弃,所用氢氧化钠溶液的体积为15.00mL 根据题给反应得氮原子与氢氧化钠之间的关系式:N——NaOH,代入数据计算可得,0.6g样品中含氮原子的物质的量为0.08mol/L×0.015L×5=0.006mol,其质量为0.084g,质量分数为14%;(2)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,代入计算得氢氧化钠溶液的体积偏小,则此实验测定的含氮量比实际值偏小;
Ⅲ.如果测定碳酸氢铵中的含氮量时,使用甲醛法不合理,理由是因为用氢氧化钠标准溶液滴定时,溶液中HCO3—中的H+也会和氢氧化钠中和。
本题难度:困难
2、选择题 进行化学实验必须注意安全,下列说法正确的是(?)
A.不慎将酸溅到眼中,应立即用干布擦,后边洗边眨眼睛
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C.酒精在实验台上燃烧时,用水扑灭火焰
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
参考答案:B
本题解析::A.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛,以最大程度减小对眼睛的危害,故A错误;
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液,以中和碱液,故B正确;
C、洒在桌面上的酒精燃烧起来,立即用湿抹布或沙子扑盖,可以有效的隔绝空气、灭火,故C错误.
D、配制硫酸溶液时,可先在烧杯中加入一定体积的水,再在搅拌下慢慢加入浓硫酸,故D错误.
故选B。
点评:本题考查了化学实验安全及事故处理,难度不大,易错选项是D,注意:量筒不能配制溶液只能量取溶液。
本题难度:简单
3、选择题 下列对实验现象的解释与结论正确的是
编号
| 实验操作
| 实验现象
| 解释与结论
| A
| 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验
| 试纸变蓝
| NO2为酸性气体
| B
| 向某溶液中加入BaCl2溶液
| 有白色沉淀产生
| 生成难溶于水的BaSO4,该
溶液中一定含有SO42-
| C
| 向甲苯中滴入少量浓溴水,振荡,静置
| 溶液分层,上层呈橙红色,下层几乎无色
| 甲苯和溴水发生取代反应,
使溴水褪色
| D
| 向蔗糖中加入浓硫酸
| 变黑,放热,体积膨胀,放出刺激性气体
| 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等
参考答案:D
本题解析:A中结论不正确,应该是NO2具有氧化性;B不正确,也可能含有CO32-、SO32-;和Ag+等;C不正确,发生的是萃取,因此正确的答案选D。
本题难度:一般
4、选择题 用下图所示装置及药品进行相应实验,能达到实验目的的是

A.图l除去Cl2中含有的少量HCl
B.图2蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.图3除去Fe(OH)3胶体中的FeCl3
D.图4分离CCl4萃取碘水后的有机层和水层
参考答案:D
本题解析:A不正确,因为氯气液能和?氢氧化钠溶液反应,应该用饱和的食盐水;B不正确,因为在加热的条件下,氯化铵容易分解生成氯化氢和氨气;C不正确,胶体和溶液均能透过滤纸,应该用半透膜进行渗析;D正确,属于碘的萃取,答案选D。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
5、实验题 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为??。
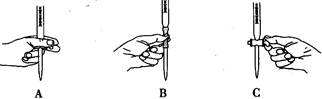
(2)滴定过程中操作滴定管的图示正确的是??。
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度?
(填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号
| 温度(℃)
| 催化剂
用量(g)
| 酸性高锰酸钾溶液
| 实验目的
a. 实验1和2探究?;
b. 实验1和3探究反应物浓度对该反应速率的影响;
c. 实验1和4探究催化剂对该反应速率的影响。
| 体积
(mL)
| 浓度
(mol?L-1)
| 1
| 25
| 0.5
| 4
| 0.1000
| 2
| 50
| 0.5
| 4
| 0.1000
| 3
| 25
| 0.5
| 4
| 0.0100
| 4
| 25
| 0
| 4
| 0.1000
|
?
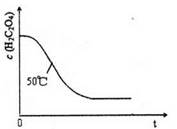
(4)写出表中a 对应的实验目的?;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号
| 溶液褪色所需时间(min)
| 第1次
| 第2次
| 第3次
| 1
| 14.0
| 13.0
| 11.0
| 3
| 6.5
| 6.7
| 6.8
|
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案?。
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,原因可用离子方程式表示为?。
参考答案:(每空2分)
(1)2MnO4—+5H2C2O4+6H+= 2Mn2+ + 10CO2 ↑+ 8H2O
(2)A
(3) 偏高
(4)探究温度不同对反应速率的影响
(5)其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间。
(6)2MnO4—+ 10Cl— + 16H+ = 5Cl2↑+ 2Mn2+ + 8H2O
本题解析:(1)草酸(H2C2O4)溶液与酸性KMnO4溶液发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为Mn2+,离子方程式为2MnO4—+5H2C2O4+6H+= 2Mn2+ + 10CO2 ↑+ 8H2O;
(2)酸性高锰酸钾氧化性强,所以在该实验中选择酸式滴定管,滴定时用左手的大拇指、食指、中指旋转滴定管的旋塞,所以答案选A;
(3)若滴定前滴定管尖嘴处有气泡,对初读数无影响,但滴定后消失,会使末读数偏大,二者的差值为酸性高锰酸钾溶液滴定的体积,导致计算出的草酸溶液的浓度偏高;
(4)实验1和2相比,只有温度不同,所以a的目的是探究温度不同对反应速率的影响;25°C低于50°C,所以反应速率慢,溶液褪色所需时间长,所画曲线的起点相同,较平缓,在50°C曲线的略上方即可;
(5)探究反应物浓度对速率影响时应在其他条件不变时改变某种反应物的浓度,在本实验中褪色的是酸性高锰酸钾溶液,所以酸性高锰酸钾的溶液的体积、浓度 应是不能变的,而只改变草酸的浓度(体积不变),观察溶液褪色的时间,所以其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间。
(6) 该实验中使用的催化剂应选择MnSO4而不是MnCl2,是因为氯离子与酸性高锰酸钾溶液发生氧化还原反应 而生成氯气,消耗酸性高锰酸钾溶液,使滴定结果偏高,发生的离子方程式是2MnO4—+ 10Cl— + 16H+ = 5Cl2↑+ 2Mn2+ + 8H2O
本题难度:一般
|
|