1、填空题 下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
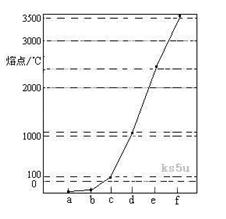
(1)请写出上图中d单质对应元素原子的电子排布式?。
(2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含?个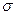 键和?个
键和?个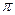 键。
键。
 (3)a与b的元素形成的10电子中性分子X的空间构型为?;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为?,其中X与Ag+之间以?键结合。
(3)a与b的元素形成的10电子中性分子X的空间构型为?;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为?,其中X与Ag+之间以?键结合。
(4)下图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因?。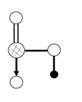
参考答案:(1)1s22s22p6 3s2 3p63d104s1(2分)
(2)3?2 (各2分)
(3)三角锥形(1分);[Ag(NH3)2]+(1分),配位(2分)
(4)HNO3是极性分子,易溶于极性的水中(1分);HNO3分子中的—OH易与水分子之间形成氢键(1分)
本题解析:略
本题难度:一般
2、选择题 下列分子或离子中,含有孤对电子的是( )?
A.NH4+
B.CO2
C.SiH4
D.CH4
参考答案:B
本题解析:根据微粒的电子式可知,选项ACD中都含有4个共价键,所以不存在孤对电子。CO2中每个氧原子含有2对孤对电子,答案选B。
点评:该题是中等难度的试题,试题基础性强,侧重对常见微粒电子式的考查与应用,有利于培养学生的抽象思维能力和灵活应变能力。
本题难度:简单
3、选择题 短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
A.气态氢化物的热稳定性:HnY>HnW
B.同周期元素中W的最高价氧化物对应水化物的酸性最强
C.Y和X、Z和X组成的常见化合物中化学键的类型相同
D.原子半径的大小顺序: rW>rZ>rY>rX
参考答案:A
本题解析:由题意可知元素X、Y、Z、W分别为H、O、Na、S,A、元素的非金属性越强,其对应氢化物越稳定,正确;B、元素的非金属性越强,最高价氧化物对应水化物酸性越强,Cl非金属性强于S,所以HClO4是该周期中最强的酸,错误;D、Y和X、Z和X组成化合物分别是H2O或H2O2,Na 2O 或Na2O2,分别为共价化合物和离子化合物,化学键类型不同,错误;原子半径的大小顺序:rZ>rW>rY>rX,错误。
本题难度:简单
4、选择题 下列四种元素中,其单质氧化性最强的是
A.原子含未成对电子最多的第二周期元素
B.原子最外层电子排布为2s22p4的元素
C.位于周期表中第三周期ⅢA族的元素
D.原子最外层电子排布为3s23p3的元素
参考答案:B
本题解析:根据元素的结构、位置和核外电子的排布规律可知,A是N、B是O、C是Al,D是P。因此单质氧化性最强的是氧气,答案选B。
本题难度:一般
5、选择题 具有相同质子数的两种粒子(? )
A.一定是同种元素
B.一定是一种分子和一种离子
C.一定是不同离子
D.无法判断
参考答案:D
本题解析:举反例。例如:A项中Ne和CH4,B项中H3O+和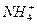 ,C项中
,C项中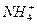 和Na。A、B、C三项都有可能。
和Na。A、B、C三项都有可能。
本题难度:简单