1、填空题 以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:
化合物
| 燃烧热
| 化合物
| 燃烧热
|
甲烷
| 891.0
| 正丁烷
| 2 878.0
|
乙烷
| 1560.8
| 异丁烷
| 2 869.6
|
丙烷
| 2 221.5
| 2-甲基丁烷
| 3 531.3
|
?
(1)已知:物质的能量越高越不稳定,根据表中的数据,比较正丁烷、异丁烷的热稳定性:正丁烷______异丁烷(填“>”、“=”或“<”)。
(2)写出乙烷燃烧的热化学方程式:________________________
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量______(填“越多”、“越少”或“相同”)。
参考答案:(1)<?(2)2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)? ΔH=-3121.6kJ/mol?(3)越少
本题解析:根据表中的数据可以看出:正丁烷的燃烧热为2 878.0 kJ/mol;而异丁烷的燃烧热为2 869.6 kJ/mol。由于物质的能量越高越不稳定,因此稳定性正丁烷<异丁烷。(2)根据已知的燃烧热的数据可得乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)? ΔH=-3121.6kJ/mol。(3) 对于烷烃来说,分子式通式为CnH2n+2。可见:随着分子中C原子数的增多,C的含量逐渐增大。1g甲烷完全燃烧产生的热量为891.0KJ÷16=55.7KJ;1g乙烷完全燃烧产生的热量为1560.8KJ÷30=52.0KJ;对其它烷烃进行计算会发现:相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少。
本题难度:一般
2、选择题 今有室温下四种溶液,有关叙述不正确的是( )
?
| ①
| ②
| ③
| ④
|
pH
| 11
| 11
| 3
| 3
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸
| 盐酸
|
?
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(N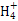 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.Va L ④与Vb L ②溶液混合,若混合后溶液pH=4,则Va∶Vb=11∶9
参考答案:C
本题解析:①、②中分别加入适量的氯化铵晶体后,因为铵根离子要结合氢氧根离子,溶液的碱性减弱,两溶液的pH均减小,A正确;分别加水稀释10倍,氢氧化钠pH减小1,盐酸pH增大1,氨水减小的比1小,醋酸增大的比1小,所以①>②>④>③,B正确;①、④两溶液等体积混合,由于氨水的浓度远大于盐酸的浓度,故氨水过量,溶液显碱性,因此有:c(N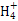 )>c(Cl-)>c(OH-)>c(H+),C错误;Va L④与Vb L ②溶液混合,若混合后溶液pH=4,
)>c(Cl-)>c(OH-)>c(H+),C错误;Va L④与Vb L ②溶液混合,若混合后溶液pH=4, =10-4 ,则Va∶Vb=11∶9,D正确。
=10-4 ,则Va∶Vb=11∶9,D正确。
本题难度:一般
3、选择题 下列溶液中,微粒浓度关系正确的是
A.含有NH4+、Cl-、H+、OH-离子的溶液中,其离子浓度一定是:
c(Cl-)>c(NH4+)> c(H+)> c(OH-)
B.pH=6的醋酸与醋酸钠的混合溶液中c(Na+)>c(CH3COO-)
C.0.lmol/L的Na2S溶液中,c(OH-)= c(H+)+ c(HS-)+2 c(H2S)
D.pH=3的一种酸和pH=11的一种碱等体积混和后的溶液中一定是c(OH-)=c(H+)
参考答案:C
本题解析:A、含有NH4+、Cl-、H+、OH-离子的溶液中,其离子浓度还可能是c(NH4+)> c(Cl-)> c(OH-)>c(H+),错误;B、pH=6的醋酸与醋酸钠的混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,所以c(Na+)<c(CH3COO-),错误;C、0.lmol/L的Na2S溶液中,水电离产生的c(OH-)=c(H+),而S2-的水解结合水电离出来的H+而生成HS-、H2S,根据质子守恒规律,有c(OH-)= c(H+)+ c(HS-)+2 c(H2S),正确;D、pH=3的一种酸和pH=11的一种碱的强弱未知,所以等体积混和后的溶液的酸碱性未知,错误,答案选C。
本题难度:一般
4、选择题 下列有关溶液中粒子浓度的关系式中,正确的是
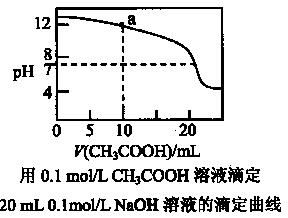
A.pH相同的①CH3COONa、②NaHCO3、③苯酚钠三份溶液中的c(Na+):③>②>①
B.0.lmol·L -1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+ c(HA-)+c(H2A)
C.上图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+)
D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+) +c(CH3COO-) +2c(CH3COOH)
参考答案:D
本题解析:A、pH相同的①CH3COONa、②NaHCO3、③苯酚钠三份溶液均显碱性,C(OH-)相同,其中苯酚的酸性最弱,水解程度最大,要得到相同的OH-,需要的盐溶液的浓度最小,醋酸的酸性最强,水解程度最小,要得到相同的OH-,需要的盐溶液的浓度最大,三份溶液中,c(Na+):③<②<①,错误;B、0.lmol·L -1某二元弱酸强碱盐NaHA溶液,根据物料守恒,c(Na+)=c(A2-)+ c(HA-)+c(H2A),错误;C、上图中pH=7时,c(OH-)=c(H+),得到的是醋酸钠和醋酸的混合溶液,根据电荷守恒,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),c(Na+)=c(CH3COO-),错误;D、a点溶液醋酸加入10ml,恰好反应了10mlNaOH ,得到醋酸钠和NaOH的混合溶液,根据物料守恒,有c(Na+)= 2(CH3COO-)+2c(CH3COOH),代入电荷守恒c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),,则有c(OH-)=c(H+) +c(CH3COO-) +2c(CH3COOH),正确
本题难度:一般
5、选择题 下列热化学方程式中的△H能表示物质燃烧热的是( )
A.2?CO(g)+O2(g)=2?CO2(g);△H=-566?KJ?mol-1
B.CH4(g)+2?O2(g)=CO2(g)+2?H2O(l);△H=-890?KJ?mol-1
C.2?H2(g)+O2(g)=2?H2O(l);△H=-571.6?KJ?mol-1
D.H2(g)+Cl2(g)=2?HCl(g);△H=-184.6?KJ?mol-1
参考答案:A、CO的化学计量数为2,△H不代表燃烧热,故A错误;
B、CH4的化学计量数为1,产物为稳定氧化物,△H代表燃烧热,故B正确;
C、H2的化学计量数为2,△H不代表燃烧热,故C错误;
D、HCl不是氧化物,△H不代表燃烧热,故D正确.
故选B.
本题解析:
本题难度:简单