1、选择题 下列叙述中正确的是
A.卤族元素是典型的非金属元素,因此不能与其他非金属元素反应
B.碱金属元素单质越活泼,其熔点和沸点就越高
C.卤族元素单 质都能与水剧烈反应
质都能与水剧烈反应
D.卤族元素单质都能和氢气反应,且气态 氢化物的稳定
氢化物的稳定 性随单质氧化
性随单质氧化 性的增强而增强
性的增强而增强
参考答案:D
本题解析:略
本题难度:一般
2、选择题 某元素X 的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式可能为
A. H2XO3
B. HXO3
C. HXO
D. H2XO4
参考答案:B
本题解析:根据X的氢化物可知,X的最低价是-3价,属于第ⅤA,因此最高价是+5价。所以选项B正确,答案选B。
本题难度:一般
3、填空题 下表为元素周期表的一部分,a、b、c…为元素周期表中前4周期的部分元素。
回答下列问题:
a
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| e
| f
| g
| ?
|
?
| b
| ?
| ?
| ?
| hh
| ?
| ?
| ?
|
c
| ?
| ?
| ?
| ?
| ?
| ?
| d
| [
| d
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
(1)d3+的未成对电子数为??个;
(2)请比较e、f、g三种元素的第一电离能由大到小的顺序?(写元素符号)
(3)请写出h元素原子价电子轨道表示式?;
(4)ea3分子的电子式是?,其分子的空间构型是?,分子中e原子的杂化类型是?。
参考答案:(每空2分)(1)? 5?(2)? F>N>O?(3)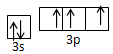
(4)(每空1分)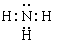 ,三角锥?, sp3
,三角锥?, sp3
本题解析:根据元素在周期表中的相对位置可知,a是H,b是Mg,c是K,d是Fe,e是N,f是O,g是F,h是P。
(1)根据铁离子的核外电子排布式可知,d3+的未成对电子数为5个。
(2)非金属越强,第一电离能越大。但由于氮元素的2p轨道电子分别处于半充满状态,稳定性强,第一电离能大于氧元素的,即电负性是F>N>O。
(3)根据构造原理可知,P元素原子价电子轨道表示式为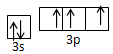 。
。
(4)氨气分子中氮原子含有1对孤对电子,所以是三角锥形结构,氮原子是sp3杂化,其电子式是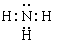 。
。
点评:该题是高考中的常见考点,属于基础性试题的考查。试题综合性强,难易适中,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理和抽象思维能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、选择题 下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
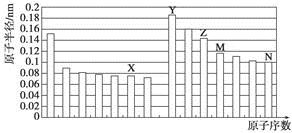
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
参考答案:D
本题解析:根据原子半径的递变规律,X为O,Y为Na,Z为Al,M为Si,N为Cl。A项,离子半径:Cl->Al3+;B项,沸点:H2O>HCl;C项,SiO2既能与HF反应,也能与NaOH溶液反应,错误;D项,Al2O3是两性氧化物,既可以和NaOH(Y)溶液反应,又能与HCl(N)反应。
本题难度:一般
5、选择题 38Sr(锶)与37Rb(铷)是同周期的相邻元素,下列有关锶的说法错误的是
A.38Sr是第3周期ⅡA族元素
B.Sr的离子半径比Kr(氪)的原子半径大
C.Sr的碳酸盐受热会分解
D.Sr的氧化物对应水化物碱性比Rb的氧化物对应水化物碱性弱
参考答案:AB
本题解析:38Sr是第5周期元素,A不正确。Sr离子和Kr的核外电子排布相同,原子序数越大,微粒半径越小,锶的原子序数大于氪的,B不正确。同主族元素,性质相似,且自上而下金属性逐渐增强,所以C、D均正确。答案选AB。
本题难度:一般