1、选择题 下列每组的三种物质中,两边的固体均有导线连接,插入中间的液体中,其中能组成原电池的是( )
A.Zn|H2SO4(稀)|C
B.Cu|酒精|Ag
C.Zn|CCl4|Cu
D.Fe|H2SO4(稀)|Fe
参考答案:A、具备原电池的构成条件,所以能组成原电池,故A正确.
B、乙醇是非电解质,且不能自发的进行氧化还原反应,故B错误.
C、四氯化碳是非电解质,且不能自发的进行氧化还原反应,故C错误.
D、两电极活泼性相同,故D错误.
故选A.
本题解析:
本题难度:一般
2、选择题 下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒,蔗糖溶液
B.锌片、石墨棒,硫酸铜溶液
C.锌片、铜片,稀盐酸
D.铜片、银片,硝酸银溶液
参考答案:A、蔗糖溶液不是电解质溶液,故A错误.
B、符合原电池的构成条件,故B正确.
C、符合原电池的构成条件,故C正确.
D、符合原电池的构成条件,故D正确.
故选A
本题解析:
本题难度:一般
3、填空题 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒.
②乙池中阳极的电极反应式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______.
②甲池中碳极上电极反应式是______,乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”).
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去.这是因为过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,该反应的化学方程式为______.
④若乙池转移0.02mol?e-后停止实验,池中溶液体积是200mL,测溶液混匀后的pH=______.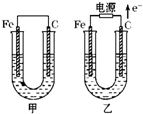
参考答案:甲装置是原电池,较活泼的金属铁作负极,碳作正极,乙有外接电源属于电解池,根据电子的流向知,碳是阳极,铁是阴极,阳极上失电子发生氧化反应;
(1)若两池中均为CuSO4溶液,反应一段时间后,①甲池中,正极上铜离子得电子而析出铜,乙池中,阴极铁棒上铜离子得电子而析出铜;
②乙池中阳极上,氢氧根离子失电子生成氧气和水,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:①碳、铁,②4OH--4e-=2H2O+O2↑,
(2)若两池中均为饱和NaCl溶液,
①电解氯化钠溶液时,阳极上氯离子失电子生成氯气,阴极上水得电子生成氢气 和氢氧根离子,所以电池反应式为:2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-;
②甲池中碳极上氧气得电子和水反应生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,
乙池碳极上氯离子失电子发生氧化反应,
故答案为:2H2O+O2+4e-=4OH-,氧化反应;
③过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
④设生成氢氧化钠的浓度是Cmol/L,
2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-转移电子
?2mol 2mol
?0.2Cmol 0.02mol?
C=2mol×0.02mol2mol×0.2mol=0.1,即氢氧化钠的物质的量浓度是0.1mol/L,则溶液的pH=13,
答:氢氧化钠溶液的pH=13.
本题解析:
本题难度:一般
4、选择题 下图是一种航天器能量储存系统原理示意图.下列说法正确的是
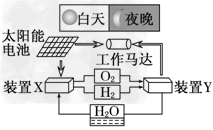
[? ]
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e-===4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
参考答案:C
本题解析:
本题难度:一般
5、选择题 有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀H2SO4中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4中,电流由D→导线→C;
③A、C用导线相连后,同时浸入稀H2SO4中,C极产生大量气泡;
④B、D用导线相连后,同时浸入稀H2SO4中,D极发生氧化反应。据此判断四种金属的活动性顺序为( )
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
参考答案:B
本题解析:金属与稀H2SO4组成原电池,活泼金属为负极,失去电子发生氧化反应,较不活泼的金属为正极,H+在其表面得到电子生成H2,外电路中电子流动方向由负极
本题难度:一般