1、填空题 如图为持续电解含有一定量CaCl2水溶液(含酚酞)的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入电解液中。
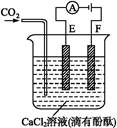
(1)电解时,F极发生 反应,电极反应为 ,E极发生 反应,电极反应为 ,电解总反应为 。?
(2)电解池中产生的现象:
① _____________________
② _____________________
③ _____________________
参考答案:(1)氧化 2Cl--2e- Cl2↑ 还原 2H++2e-
Cl2↑ 还原 2H++2e- H2↑ 2Cl-+2H2O
H2↑ 2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(2)①通电后E极处溶液呈红色 ②通电时,E极、F极均有气体生成 ③通入CO2时,溶液中先出现白色沉淀,继续通入CO2沉淀又消失
本题解析:溶液中含有:Ca2+、H+、Cl-、OH-,通电时,Ca2+、H+移向阴极,H+放电能力比Ca2+强,在E极上发生反应:2H++2e- H2↑,H2O电离出的H+放电,OH-富集在阴极(E极),则使阴极区溶液变红;Cl-、OH-移向阳极,Cl-在阳极放电,2Cl-
H2↑,H2O电离出的H+放电,OH-富集在阴极(E极),则使阴极区溶液变红;Cl-、OH-移向阳极,Cl-在阳极放电,2Cl- Cl2↑+2e- ,总反应方程式:2Cl-+2H2O
Cl2↑+2e- ,总反应方程式:2Cl-+2H2O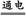 Cl2↑+H2↑+2OH-;电解一段时间t1后,溶液中OH-浓度增大,相当于Ca(OH)2、CaCl2的混合溶液,通入CO2:Ca2++2OH-+CO2
Cl2↑+H2↑+2OH-;电解一段时间t1后,溶液中OH-浓度增大,相当于Ca(OH)2、CaCl2的混合溶液,通入CO2:Ca2++2OH-+CO2 CaCO3↓+H2O,继续通入CO2:CaCO3+CO2+H2O
CaCO3↓+H2O,继续通入CO2:CaCO3+CO2+H2O Ca(HCO3)2。
Ca(HCO3)2。
本题难度:一般
2、填空题 (14分)课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:___________?_____。
(3)设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)装置丁中的现象是________________________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为?mol/L。
参考答案:(1)负极?(2)CuSO4+Fe Cu+FeSO4?(3)1:1
Cu+FeSO4?(3)1:1
(4)粗铜?变小?(5)Y极附近红褐色变深?(6)0.4
本题解析:(1)电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明是氢离子放电,溶液呈碱性,F极为阴极,也就是说B为负极。
(2)铁为阳极失电子,溶液中的铜离子得电子,则总反应为:CuSO4+Fe Cu+FeSO4
Cu+FeSO4
(3)由(2)可知铁、铜的物质的量相同
(4)粗铜的精炼,阳极G应该为粗铜,由于其中一些杂质金属放电,导致溶液中的铜离子浓度减小
(5)考查胶体的电泳现象
(6)由关系式Cl2~ FeSO4可知甲池中所生成的FeSO4的物质的量浓度为0.4mol/L
本题难度:一般
3、选择题 如图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na+通过。下列说法错误的是
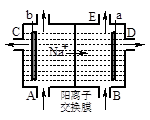
A.a极的电极反应式为:2 H++ 2 e H2 ↑
H2 ↑
B.D口导出的是NaOH溶液
C.浓盐水从A口注入
D.C口导出的是NaOH和NaCl的混合溶液
参考答案:D
本题解析:A.钠离子向a极移动,则a为阴极,发生2H++2e﹣=H2↑,故A正确;B.阴极生成OH﹣,且Na+向阴极移动,则产品烧碱溶液从D口导出,故B正确;C.电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,即浓盐水从A口注入,故C正确;D.阳离子交换膜仅允许Na+通过,则在C口不可能有NaOH导出,故D错误。故选D。
本题难度:一般
4、填空题 (10分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连。请回答以下问题:
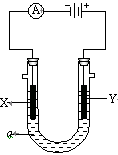
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中X极上的电极反应式为?。
②检验该Y电极反应产物的方法是?
③该反应的总反应方程式是:?
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极电极反应式是?,
② Y电极的材料是?。
参考答案:(1)①2H+ +2e– ="=" H2↑(2分)
②把湿润的KI淀粉试纸放在Y电极附近,试纸变蓝色。(2分)
③2NaCl + 2H2O 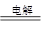 2NaOH + H2↑ + Cl2↑ (2分)
2NaOH + H2↑ + Cl2↑ (2分)
(2)①Cu2+ +2 e–="=" Cu(2分)②粗铜(2分)
本题解析:考查电化学的应用。
(1)①X电极和电源的负极相连,作阴极,溶液中的氢离子放电生成氢气,电极反应式是2H+ +2e– ="=" H2↑。
②Y电极是阳极,溶液中的氯离子放电,生成氯气,而氯气检验强氧化性,据此可以鉴别,即把湿润的KI淀粉试纸放在Y电极附近,试纸变蓝色。
③阴极还产生氢氧化钠,所以总的反应式是2NaCl + 2H2O 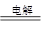 2NaOH + H2↑ + Cl2↑。
2NaOH + H2↑ + Cl2↑。
(2)粗铜精炼时,粗铜和电源的正极相连,作阳极,失去电子,所以Y电极是粗铜;纯铜和电源的负极相连,作阴极,溶液中的铜离子放电,所以X电极的电极反应式是Cu2+ +2 e–="=" Cu。
本题难度:一般
5、选择题 下列金属适合用电解法冶炼的是:
A.铁
B.银
C.锌
D.铝
参考答案:D
本题解析:略
本题难度:简单