1、选择题 最近我国某近代物理研究所取得重大科技成果,研制出首批氧-18气体。氧-18是一种稳定的同位素,称</PGN0014A.TXT/PGN>为重氧。下列有关说法正确的是
A.1.8g氧-18气体的物质的量是0.1mol
B.1mol重氧水H218O所含的中子数约为6.02×1023
C.0.2 mol氧-18气体的体积约为4.48 L
D.氧-18气体的摩尔质量是36g/mol
参考答案:D
本题解析:同位素化学性质和元素相同,故18O气体也是双原子分子
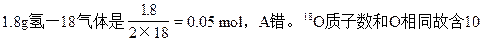
个中子,H原子无中子,一个H218O分子有10个中子,1mol H218O中有10 mol中子即6.02×1024个中子,B错。
0.2 mol气体只有在标准状况下才是4.48L,C错,
18O气体分子式为18O2,摩尔质量确为36g/mol。
本题难度:一般
2、选择题 将标准状况下a?L?HCl溶于1?000?g水中,得到的盐酸密度为b?g/cm3,则该盐酸的物质的量浓度是
[? ]
A.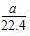 mol/L?
mol/L?
B.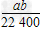 mol/L
mol/L
C.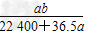 mol/L
mol/L
D.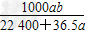 mol/L
mol/L
参考答案:D
本题解析:
本题难度:一般
3、选择题 向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法正确的是
A.Cu与Cu2O 的物质的量之比为1:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
参考答案:D
本题解析:39.2g沉淀是氢氧化铜,物质的量是0.4mol。如果设铜和氧化亚铜的物质的量分别是x和y,则64x+144y=27.2g和x+2y=0.4mol,解得x=0.2mol,y=0.1mol,所以选项A不正确;反应中共转移电子是0.2mol×2+0.1mol×2=0.6mol,所以根据电子的得失守恒可知,生成NO是0.6mol÷3=0.2mol,但体积不一定是4.48L,选项C不正确;生成物硝酸钠是1mol,所以原硝酸的物质的量是1mol+0.2mol=1.2mol,浓度是1.2mol÷0.5L=2.4mol/L,选项B不正确;生成硝酸铜是0.4mol,所以剩余硝酸是1.2mol-0.4mol×2-0.2mol=0.2mol,选项D正确,答案选D。
本题难度:简单
4、选择题 设NA为阿伏加德罗常数,则下列说法中正确的是
A.2 mol的NO2与水完全反应转移电子数为2NA。
B.39 g Na2O2晶体中所含阴阳离子个数均为2NA
C.3.4 g氨中含有0.6NA个N—H键
D.在pH=13的NaOH溶液中,OH-数目为0.1NA
参考答案:C
本题解析:3NO2+H2O=2HNO3+NO,因此2mol的NO2与水完全反应转移电子数为4/3NA。39 g Na2O2晶体中所含阴阳离子个数分别为NA、0.5NA,每个氨分子含3个共价键,则C正确;pH=13的NaOH溶液不知其体积无法求OH-数目。
本题难度:一般
5、选择题 NA为阿伏加德罗常数,下列叙述正确的是 [M(Fe)=56]
A.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
B.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
C.5.6 g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA
D.1mol过氧化氢分子中共用电子对数为3NA
参考答案:D
本题解析:A选项不知道溶液的体积,故醋酸分子的数目不能确定,A错误;B没说标况,气体的物质的量不能求算,分子数不能确定,B错误;5.6 g即0.1mol铁粉完全反应需要氯气0.15mol,氯气不足应按氯气计算转移电子数为0.2 NA,C错误;过氧化氢的电子式为:
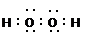 ?,所以1mol过氧化氢分子中共用电子对数为3NA,D正确。
?,所以1mol过氧化氢分子中共用电子对数为3NA,D正确。
本题难度:一般